Vrste adiabatskih procesov, primeri, rešene vaje
- 1581
- 154
- Percy Feeney
A Adiabatski proces To je tisti, kjer med sistemom in okolico ni izmenjave toplote, bodisi zato, ker se pojavlja znotraj izolacijskega medija, ali ker mine zelo hitro. To pomeni, da v okolici sistema, to je del preučevanja vesolja, temperaturnih sprememb ne bi smeli zaznati, ampak le delovati.
To je eden od osnovnih procesov termodinamike. Za razliko od drugih procesov (izokoričnih, izobaričnih in izotermalnih) nobena fizična spremenljivka ne ostane konstantna; to pomeni, da se velikosti tlaka, volumna, temperature in entropije spreminjajo, ko se razvija adiabatski proces.
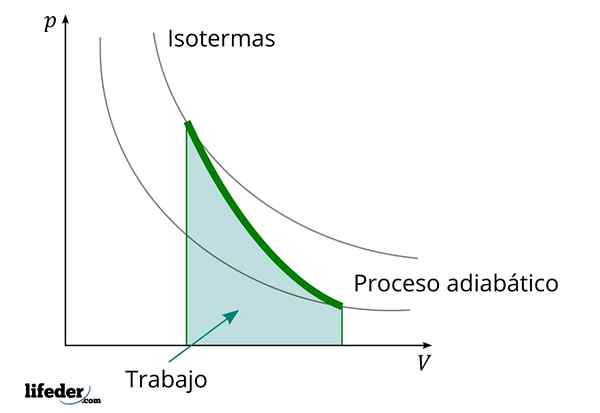
 Med adiabatskim procesom, v katerem se volumen povečuje, se notranja energija snovi, ki jo dela, zmanjšuje
Med adiabatskim procesom, v katerem se volumen povečuje, se notranja energija snovi, ki jo dela, zmanjšuje Druga pomembna značilnost adiabatskih procesov je, da opravljajo ali porabijo delo sorazmerno z variacijo notranje energije svojih sistemov; V tem primeru od tistih njegovih molekul v plinski fazi. To je mogoče pokazati zahvaljujoč prvemu zakonu termodinamike.
V vsakdanjem življenju ta vrsta procesa pokriva predvsem na geofizične pojave in do neke mere delovanje batov v dizelskih motorjih. Prenos toplote se pogosto prepreči z uporabo izolacijskega medija, vendar hitrost teh procesov omogoča njihov resnični razvoj.
[TOC]
Reverzibilni in nepovratni adiabatski procesi
Reverzibilno
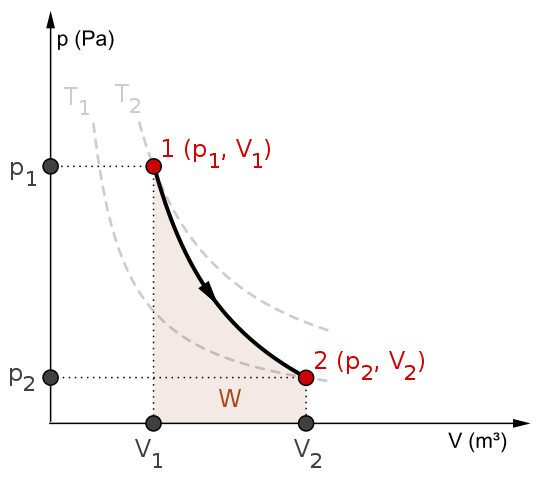 P-V diagram in delo W za adiabatski postopek. Vir: Mikerun/CC BY-SA (https: // createCommons.Org/licence/by-sa/4.0
P-V diagram in delo W za adiabatski postopek. Vir: Mikerun/CC BY-SA (https: // createCommons.Org/licence/by-sa/4.0 Adiabatski procesi so lahko reverzibilni ali nepopravljivi. Vendar prvi obstajajo le kot teoretična orodja za preučevanje slednjih. Tako reverzibilni adiabatski procesi vključujejo idealne pline in primanjkuje trenja in kakršne koli druge možnosti, ki povzroči prenos toplote med sistemom in okolico.
Razmislite na primer diagram P-V za reverzibilni adiabatski postopek od zgoraj. T1 in t2 ustrezata dvema izotermima, na katerih pritiski Str in količine V sistema se razlikuje.
Med državami (P1, V1) In p2, V2) Izvede se reverzibilna adiabatska širitev, saj se premaknemo iz zvezka V1 do enega v2, večji, po smeri puščice.
Pri tem se sistem ohladi, vendar ne da bi ubogal vedenje izoterm. Območje pod krivuljo ustreza delu w, katerega vrednost je pozitivna, ker gre za širitev.
V tem procesu entropija ostaja konstantna in zato je rečeno, da je isontropsko. Matematična obdelava te reverzibilnosti ustvarja niz enačb, s katerimi je mogoče oceniti druge sisteme.
Vam lahko služi: elektrolitske celiceNepovratna
Nepovratni adiabatski procesi, za razliko od reverzibilnih, v P-V diagramih niso grafični z neprekinjenimi, a pikčastimi črtami, saj imajo le končna in začetna stanja svoje spremenljivke (P, V in T) dobro definirane. Ti procesi vključujejo resnične pline, zato enačba idealnih plinov in njihovih izpeljavov ni neposredno uporabna.
Hitro prehajajo in preprečujejo prenos toplote med sistemom in okolico. Tudi v njih se poveča entropija, kot je navedeno v drugem zakonu termodinamike.
Primeri adiabatskih procesov
 Izolacijska sposobnost, kot je tista, ki jo je predstavil termos, je eden ključnih dejavnikov za postopek, ki se razvija
Izolacijska sposobnost, kot je tista, ki jo je predstavil termos, je eden ključnih dejavnikov za postopek, ki se razvija Nekaj primerov adiabatskih procesov bo omenjeno spodaj.
Širitev in razumevanje
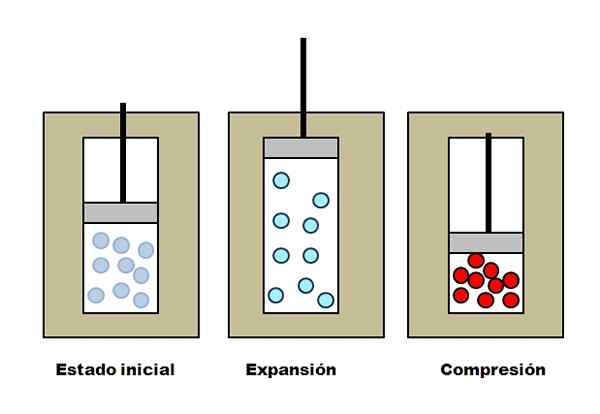 Adiabatska širitev in razumevanje. Vir: Gabriel Bolívar.
Adiabatska širitev in razumevanje. Vir: Gabriel Bolívar. Recimo, da trije izolacijski jopiči, ki vsebujejo predelke, polne s plinom. V začetnem stanju bat nima pritiska na plin. Nato se bat pusti, da se dvigne, kar povečuje prostornino, skozi katero se lahko premikajo molekule plina, kar povzroči zmanjšanje njegove notranje energije; In zato znižanje temperature.
Z adiabatsko stiskanje se zgodi nasprotno: bat deluje na plin, kar zmanjšuje količino, ki jo lahko zasedejo njegove molekule. Notranja energija se ta čas poveča, kar pomeni tudi zvišanje temperature, katere toplota se zaradi izolacijskega jopiča ne more razpršiti proti okolici.
Magma vzpon
Kanali, kjer se magma dviga v vulkanu, pripovedujejo kot izolacijski medij, ki preprečuje prenos toplote med magmo in atmosfero.
Zvok širjenje
Plini se motijo in razširijo glede na zvočni val, ne da bi se ohladili ali vroče zrak, ki jih obdaja.
Učinek sovražnika
Učinek sovražnika je primer adiabatskih procesov na področju geofizike. Zračne mase se vzpenjajo proti zgornjem delu gore, kjer doživljajo manj pritiska, zato se njihove molekule širijo in ohladijo, kar povzroča nastanek oblaka.
Vendar se komaj spuščajo na drugi strani gore, tlak se poveča in zato se molekule stisnejo in dvignejo temperaturo, zaradi česar oblak izgine.
Vam lahko služi: klorobenzen (C6H5Cl)V naslednjem videoposnetku je mogoče ceniti ta pojav:
Rešene vaje
Končno bo rešenih nekaj vaj. Pomembno je imeti naslednje enačbe:
ΔU = Q - W (prvi zakon termodinamike)
Ampak brez prenosa toplote, Q = 0 y:
ΔU = - W (1)
To je: če je delo w pozitivno, ΔU je negativno in obratno. Po drugi strani pa imamo tudi:
W = -nCVΔT (2)
Da po uporabi idealne enačbe (PV = nRT) in zamenjava in reševanje za t2 in t1 bomo imeli:
W = (cV/R) (str1V1 - Str2V2) (3)
Je vrednost r enaka 0.082 L · ATM/mol · K ali 8.314 j/mol · k
V adiabatskih procesih je pomembno vedeti odnos CStr/CV znan kot γ:
γ = cStr/CV (4)
Ki omogoča vzpostavitev odnosov T-V in P-V:
T1V1γ-1 = T2V2γ-1 (5)
Str1V1γ = P2V2γ (6)
In tudi približne toplote cStr in cV Razlikujejo se glede na to, ali so plini monoatomski, diatomski itd.
Vaja 1
Plin opravi 600 j dela skozi izolirani predel. Kakšna je sprememba njegove notranje energije? Ali se temperatura znižuje ali poveča? In če upoštevamo, da gre za monoatomski plin, izračunajte tudi γ.
Podatki:
W = +600J
ΔU = ¿?
γ =?
W delo je pozitivno, ker plin deluje na okolici. V notranjosti izoliranega oddelka, Q = 0, zato bomo imeli enačbo (1):
ΔU = - W
To pomeni, da je ΔU enak:
ΔU = - (+600J)
= -600J
Kar pomeni, da se je notranja energija plina zmanjšala za 600 j. Če se ΔU zniža, tako tudi temperatura, zato se plin ohladi, ker je opravil delo.
Ker je ta plin monoatomski,
CV = 3/2 r
CStr = 5/2 r
In biti
γ = cStr/CV
= (5/2 r)/(3/2 r)
= 5/3 ali 1.66
Vaja 2
V posodi 7 molov O2 Stisnjeni so bili iz volumna od 15 do 9 litrov. Če veste, da je bila začetna temperatura 300 K, izračunajte: delo na plin.
Podatki:
n = 7 molov oz2
T1 = 300 K
V1 = 15 l
V2 = 9 l
W = ¿?
Je nepopravljivo adiabatsko razumevanje. Imamo dve enačbi za reševanje W:
W = -nCVΔT (2)
W = (cV/R) (str1V1 - Str2V2) (3)
Pritiski jih lahko izračunajo, vendar je za prihranek časa bolje nadaljevati s prvim enačbam:
Vam lahko služi: destilirana vodaW = -nCVΔT
= -nCV (T2-T1)
Potrebujemo cV in t2 Za določitev w. Kisik, ki je diatomski plin, ima CV enako 5/2 r:
CV (Bodisi2) = 5/2 r
= 5/2 (8.314 j/mol · k)
= 20.785 j/mol · k
Moramo izračunati t2. Se obrnemo na enačbo (5):
T1V1γ-1 = T2V2γ-1
Toda preden ga uporabite, morate določiti prvo cStr in γ:
CStr (Bodisi2) = 7/2 r
= 7/2 (8.314 j/mol · k)
= 29.099 J/mol · k
Biti γ enak:
γ = cStr/CV
= (29.099 J / mol · k) / 20.785 j/mol · k
= 1.4
Torej, to lahko razčistimo2 Iz enačbe (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300K) (15L)1.4-1] / (9l)1.4-1
= 368.01 K
In končno rešimo za W:
W = -nCVΔT
= -(7 mol o2) (dvajset.785 j/mol · k) (368.01 K - 300 K)
= -9895.11 J O -9.895 kJ
Vaja 3
Neonska posoda širi adiabatsko in sprva pri sobni temperaturi (t = 298k) od 12 L do 14 L. Vedeti, da je bil njen začetni pritisk 3 atm, kaj bo delo, ki ga je opravil plin?
Podatki:
T1 = 298 K
V1 = 12 l
V2 = 14 l
Str1 = 3 atm
W = ¿?
Enačba (3) nam omogoča, da določimo W z vrednostmi tlakov:
W = (cV/R) (str1V1 - Str2V2)
Vendar nam manjka cV In p2.
Končni tlak je mogoče izračunati z enačbo (6):
Str1V1γ = P2V2γ
Biti γ enako cStr/CV. Ker je Neon monoatomski plin, imamo njegove vrednosti CStr in cV So 5/2r oziroma 3/2r. Nato izračunamo γ:
γ = cStr/CV
= (5/2r)/(3/2r)
= 5/3 ali 1.66
Počistimo p2 Iz enačbe (6):
Str2 = (Str1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
In delo bo enako:
W = (cV/R) (str1V1 - Str2V2)
= (3/2) [(3 atm) (12 l) - (1.40 ATM) (14 L)] (101300 PA/1 ATM) (0.001 m3/L) (kJ/1000 J)
= 2.49 kJ
Faktorji pretvorbe se uporabljajo za pretvorbo l · atm a pa · m3, kar je enakovredno 1 j. Neon plin se širi, zato se njen tlak zmanjšuje in pri delu na okolici je to pozitivno. Tudi njegova notranja energija ΔU se znižuje, pa tudi temperatura, hlajenje v postopku širjenja.
Reference
- Walter J. Moore. (1963). Fizikalna kemija. V kemični kinetiki. Četrta izdaja, Longmans.
- Iran. Levine. (2009). Načela fizikalnokemije. Šesta izdaja. MC Graw Hill.
- Wikipedija. (2020). Adiabatski proces. Pridobljeno iz: v.Wikipedija.org
- Jones, Andrew Zimmerman. (18. avgust 2020). TheModynamics: adiabatski proces. Okreval od: Thoughtco.com
- Devoe Howard in Neils Tom. (9. avgust 2020). Adiabatske spremembe. Kemija librettexts. Okrevano od: kem.Librettexts.org

