Načelo Le Châtelierja
- 1786
- 531
- Adrian Legros
Kaj je načelo Le Châtelierja?
On Načelo Le Châtelierja Je splošno pravilo, ki napoveduje učinek, ki ga imajo različni dejavniki, ki vplivajo na kemično ravnovesje. Zlasti pomaga napovedati, v katero smer se bo reakcija, ki je v ravnovesju.
To načelo ugotovi, da:
"Kadar je sistem, ki je v ravnotežju, podvržen motnjam ali zunanjo napetost, sistem reagira v smeri, ki mu omogoča delno preprečevanje takšnih motenj.".
Motnje je dobro razumljeno:
- Sprememba koncentracije katerega koli od reagentov.
- Sprememba koncentracije katerega koli od izdelkov.
- Spremembe pritiska.
- Spremembe v glasnosti.
- Sprememba temperature
Ko se spremembe zgodijo kot omenjene, je ena od obeh reakcij, neposredna ali obratna, naklonjena drugim, tako da se sistem v tem smislu reagira proti novemu ravnovesju.
To je podobno kot prilagoditve, ki jih je na tightrope opravil balancer. Ko gravitacija hala na eni strani, se balancer reagira s premikanjem na nasprotno stran. Pravimo, da se je njegovo ravnovesje premaknilo, saj je še vedno v ravnovesju (ne pade), zdaj pa ima drugačen položaj.
Nato bomo videli, kako se načelo Le Châtelierja uporablja za napovedovanje smeri, v kateri bo sistem reagiral z različnimi vrstami napetosti ali motenj, kot so: spremembe koncentracije, volumna, tlaka in temperature.
Vpliv sprememb koncentracije
Recimo, da imamo naslednjo reakcijo v ravnovesju:
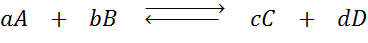
Če spremenimo koncentracijo katere koli od vpletenih vrst (A, B, C ali D), načelo Le Châtelierja napoveduje, da se bo sistem odzval na preprečevanje te spremembe bodisi tako, da bo porabil presežek, ali obnovi odpravljeno količino. 4 Različne situacije je mogoče dati:
1. Povečana koncentracija reagentov
Če na primer povečamo koncentracijo reagenta, na načelo Le Châtelierja, bo sistem reagiral, da porabi dodan presežek. To pomeni, da bo reagiral neposredno (od leve proti desni), saj se ta smer porabi na.
V tem primeru pravijo, da je neposredna reakcija naklonjena in da se je ravnovesje premaknilo proti izdelkom, saj je v novem ravnovesju koncentracija izdelkov večja od koncentracije v prvotnem ravnovesju.
Vam lahko služi: magnetna ločitev2. Povečana koncentracija produktov
Če povečamo koncentracijo izdelka, na primer C, bo sistem reagiral v vzvratnosti, da porabimo presežek C (torej od desne proti levi).
V tem primeru se reče, da je obratna reakcija naklonjena in da se ravnovesje premakne proti reagentom.
3. Zmanjšanje koncentracije reagenta
Zmanjšanje koncentracije ima nasproten učinek kot povečanje omenjene koncentracije. Če se umaknemo iz medija in tako zmanjšamo njeno koncentracijo, bo sistem reagiral na levo (v vzvratno), da bo preprečil spremembo. Ravnovesje se premakne proti reagentom.
4. Zmanjšanje koncentracije produktov
Če zmanjšamo koncentracijo C ali D, bo sistem reagiral neposredno, da bo nadomestil zmanjšano koncentracijo (torej od leve proti desni). Ravnotežje se premika proti izdelkom.
Primer:
Določite učinek dodajanja več tiocianskih ionov (SCN-) V naslednjem kemijskem ravnovesju je vedenje, da je produkt desne strani intenzivno rdeče in železo (III).
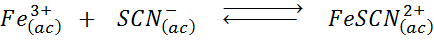
Rešitev: V tem primeru dodajamo tiocianato, ki je reagent, zato se mora ravnovesje premakniti v desno, povečati koncentracijo kompleksa in s tem intenzivnost rdeče barve v raztopini.
Vpliv sprememb v volumnu in tlaku
Spremembe volumna in tlaka ne vplivajo bistveno na reakcije v ravnovesju v tekočem ali trdnem stanju, vendar lahko vplivajo na tiste, ki jih najdemo v plinastim stanju. To je zato, ker je za pline koncentracija sorazmerna s pritiskom, kot napoveduje zakon o idealnih plinih.
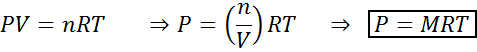
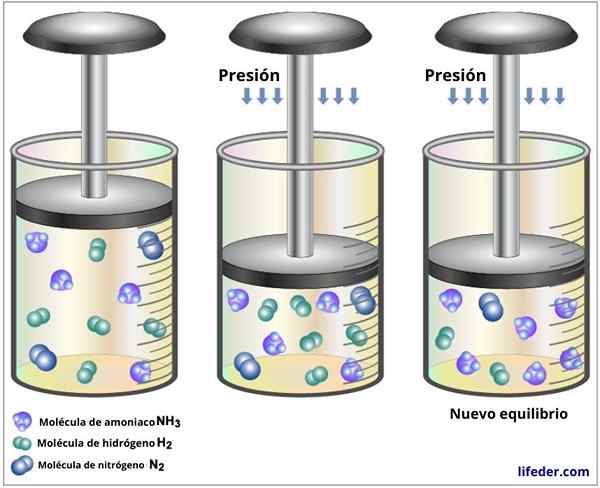
Povečanje tlaka plina, ki vzdržuje konstantno temperaturo, je enakovredno zmanjšanju njene prostornine, zato bo učinek obeh motenj enak.
Če se skupni tlak v ravnotežju poveča na reakcijo ravnotežja (ali zmanjšamo njegovo prostornino), bo sistem reagiral, da bi spet znižal tak tlak, tako da se bo ravnotežje premaknilo tam, kjer je manjša količina molekul plinastih delcev.
Vam lahko služi: kromatografija fine plasti: značilnosti, za kaj je V reakciji med dušikom in vodikom, ki tvori amoniak, porabijo 4 molekule sode in nastanejo le dve, zato povečanje tlaka premika ravnovesje proti največji tvorbi amoniaka
V reakciji med dušikom in vodikom, ki tvori amoniak, porabijo 4 molekule sode in nastanejo le dve, zato povečanje tlaka premika ravnovesje proti največji tvorbi amoniaka Če se v reakciji porabijo in se proizvede enako število molekul plina, potem spreminjanje prostornine in tlaka ne bosta vplivala.
Po drugi strani pa, če samo spremenimo delni tlak katerega koli od plinov, je učinek enak kot povečati ali zmanjšati koncentracijo omenjenih vrst.
Primer:
Glede na reakcijo razgradnje diitrogena tetroksida v ravnovesju:
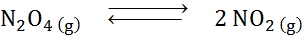
Določite učinek zmanjšanja volumna, povečanega tlaka.
Rešitev: Če povečamo skupni sistemski tlak ali zmanjšamo njegovo volumen, se ravnotežje premakne proti reagentom, saj v tej smeri neto zmanjšanje molekul plina (2 in 1) porabimo 1), kar omogoča preprečevanje povečanja tlaka.
Vpliv temperaturnih sprememb
Vpliv temperature na kemično ravnovesje se razlikuje od drugih dejavnikov, ki smo jih doslej videli. V prejšnjih primerih se po motnji dobi novo ravnovesje, vendar se ohrani enaka ravnotežna konstanta. Če pa se temperatura spremeni, se bo ravnotežna konstanta spremenila.
Če želite vedeti, kako se ravnotežna konstanta spreminja s temperaturo, je treba znati znak reakcijske entalpije:
- Če reakcija sprosti toploto, to je eksotermična, njegova entalpija je negativna in ravnotežna konstanta se znižuje, ko se temperatura zvišuje. V teh primerih se ravnotežje premika v nasprotni smeri proti reagentom.
- Če reakcija absorbira toploto, to je endotermična, njegova entalpija je pozitivna in se zgodi nasprotno.
Spominjanje učinka temperature je enostavno, če toploto štejemo za reagent, ki se pojavi v primeru eksotermičnih reakcij in se porabi v primeru endotermične. Povečanje temperature bi bilo kot "dodati" toploto v sistem in ohladiti, da bi jih bilo mogoče odstraniti.
Če je reakcija eksotermična in se temperatura poviša, bi bilo kot dodajanje produkta reakcije, tako da se ravnovesje premika v nasprotni smeri, proti reagentom, in če se ohladi nasprotno.
Lahko vam služi: píchric kislina: kaj je, struktura, sinteza, lastnostiPo drugi strani pa, če je reakcija endotermična in se temperatura zviša, bi bilo to kot dodajanje reagenta, zato se ravnovesje premakne proti izdelkom, medtem ko ima znižanje temperature nasproten učinek.
Primer:
Reakcija razgradnje n2Tudi4 Ima +58,0 kJ/mol reakcijske entalpije. V kateri smeri se bo ravnotežje premikalo, če se temperatura zniža?
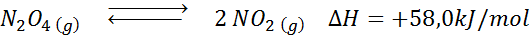
Rešitev: Ker je entalpija pozitivna, je reakcija endotermična. Zaradi tega bo hlajenje naklonjeno obratni reakciji in ravnovesje se bo premaknilo proti reagentom, torej proti tvorbi več n2Tudi4.
Vpliv katalizatorjev, zaviralcev in inertnih snovi
Katalizatorji in zaviralci vplivajo na hitrost, s katero se pojavljajo reakcije, vendar vplivajo na neposredno in posredno reakcijo. Zaradi tega ne vplivajo na ravnotežno stanje.
Po drugi strani dodajanje inertne snovi kot plina, ki ne reagira z nobenim reagentom ali produkti.
Uporaba načela Le Châtelierja
Razumevanje tega načela je zelo koristno, saj nam omogoča, da manipuliramo z ravnovesjem reakcije na naše udobje.
V tistih primerih, v katerih nas zanima.
To pomeni:
- Dodajte velike količine reagentov, če so to varčne.
- Umaknite produkt, ko reakcija napreduje, da se sistem ohrani v konstantnem stanju napetosti, vedno poskuša neposredno doseči ravnovesje, ki reagira.
- Zvišanje temperature v primeru endotermičnih reakcij.
- Povečajte pritisk na tiste reakcije, v katerih se porabi več molekul v plinu, kot se pojavljajo.
Morda bomo želeli tudi zmanjšati količino izdelka, ki ga tvori neželena reakcija. V teh primerih delamo nasprotno.
Primer uporabe načela Le Châtelierja
Pri organski sintezi se nenehno uporablja načelo Le Châtelierja za izboljšanje donosa reakcij.
Na primer, pri reakcijah na dehidracijo alkohola dodajo vsiljevanje v okolje, ki absorbira vodo, ki je nastala med reakcijo. To zmanjšuje koncentracijo omenjenega izdelka, ki izpodriva ravnotežje do izdelkov.

