Struktura vodikovega peroksida (H2O2), lastnosti, uporabe, pridobivanje

- 2757
- 567
- Raymond Moen
On vodikov peroksid To je anorganska spojina, katere kemijska formula je h2Tudi2. Vsi so najpreprostejši peroksid te družine kemičnih spojin. Njegova strukturna formula je H-O-O-H, ta notranji oksigenirani most je značilen za vse perokside.
Leta 1818, h2Tudi2 Identificiral ga je Louies Jacques Thénard, ki je pripravil kemično spojino, ki jo je pozval. Je nestabilna spojina, razpade z izpostavljenostjo svetlobi, vročini in nekaterim kovini.
 Kemična formula vodikovega peroksida
Kemična formula vodikovega peroksida To je zelo uporabna spojina, ki se uporablja pri dezinfekciji manjših ran, beljenju las, čiščenju vode itd. Čeprav ima lahko škodljiva dejanja za človeka, ga najdemo v vseh evkariontskih celicah živih bitij, kjer opravlja več koristnih funkcij.
Vodikov peroksid proizvaja oksidacijo strupenih snovi, kot so fenoli, etanol, formaldehid itd., izdelke, ki jih odpravljajo jetra in ledvice. Poleg tega prispeva k uničenju bakterij, ki jih fagocitirajo z nevtrofilskimi in makrofagi levkociti.
[TOC]
Struktura
Molekula
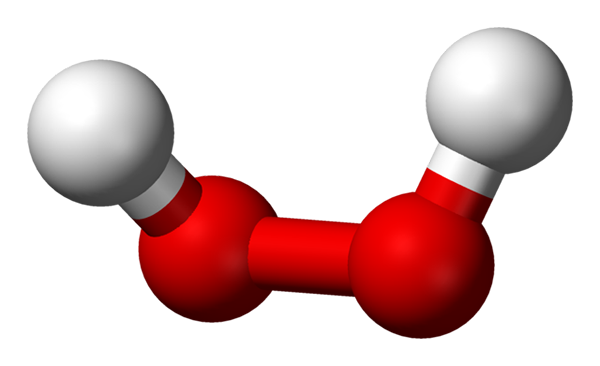 Molekula vodikovega peroksida, predstavljena z modelom kroglic in palic. Vir: Benjah-BMM27 prek Wikipedije.
Molekula vodikovega peroksida, predstavljena z modelom kroglic in palic. Vir: Benjah-BMM27 prek Wikipedije. Na vrhunski sliki je mogoče videti strukturo molekule H2Tudi2 (H-O-O-H) z rdečimi kroglami, ki ustrezajo atomom kisika, in belimi vodikovimi atomi. Upoštevajte, da molekula ni ravna in da niti atomi H niso zamrznjeni v vesolju (eden pred drugim).
Zanimivo je, da h2Tudi2 Težko je zasukati svojo preprosto osrednjo povezavo O-O, zato položajev teh H ni mogoče izmenjati; Eden ne bo šel dol, medtem ko drugi gre navzgor.
Ker? Ker v obeh atomih kisika obstajata dva para brez elektronov, kar daje skupno osem zelo tesnih elektronov in ki se med seboj odbijajo za njihove negativne naboje.
Rotacije
Kljub temu se bo povezava O-O verjetno vrtela zaradi interakcij z okolico.
Na primer, ko skupaj z obema palcoma, z iztegnjenimi prsti in drugimi zaprtimi, na primer risanje sodišča in nato palce obrnemo tako, da bo eden od prstov ciljal naprej, drugi pa bo a približna predstavitev h2Tudi2.
Če telo igra katerega koli od indeksov, se bo palce vrtelo kot odgovor na to interakcijo; Vendar se bodo takoj vrnili v prvotni položaj zaradi zgoraj omenjenih elektronskih odbojnosti. Te rotacije uokvirjajo dinamične vidike te molekule.
Medmolekularne interakcije
V tekočem stanju H2Tudi2 uspe vzpostaviti vodikove mostove (Hooh-O2H2), v nasprotnem primeru njegove visoke vrelišča (150 ° C) ne bi bilo razloženo v primerjavi z vodo.
Vam lahko služi: kalcijev sulfat (case4): kemična struktura, lastnosti, uporabeKo preide v plinsko fazo, M molekule M2Tudi2 Verjetno ne morejo več oblikovati takšnih mostov, ne le na največjo medmolekularno razdaljo, ampak tudi vodikove atome bi se prvič dotaknili v primeru trkov (to je mogoče vizualizirati tako, da se zatečemo nazaj k modelu prstov).
Medtem je v trdni fazi kot ravnin, ki vzpostavijo H, 90 ° (dajte pravokotni prsti) prsti). Zdaj vodikovi mostovi postanejo še pomembnejši in H molekule2Tudi2 Naročeni so v kristalu tetragonalne strukture.
Lastnosti
Sbotella z vodikovim peroksidom. V lekarnah ga dosežemo s koncentracijo 3% m/v. Vir: Pixnio.
Imena
-Vodikov peroksid
-Dioksidano
-Oksidanol
-Perhidoksična kislina
-O-hidroksiol
-Vodikov peroksid
Molarna masa
34.0147 g/mol
Fizični videz
Bledo modra (koncentrirana) ali brezbarvna. Je nekoliko bolj viskozen in gost kot voda. Destilira se zaradi varnosti pri nizkih temperaturah in znižanem tlaku, saj se razpade z eksplozivnim ogrevanjem.
Vonj
Akutni ali vonj, podoben ozonu.
Okus
Grenka
Gostota
Trden 1,71 g/cm3
Gostota njihovih vodnih rešitev je odvisna od njihove koncentracije; Na primer, 27 % ima gostoto 1,10 g/cm3, medtem ko 50 %, 1,13 g/cm3
Tališče
- 0,43 ° C
Vrelišče
150,2 ° C. Ta vrednost je bila pridobljena z ekstrapolacijo, saj se vodikov peroksid razpade pri visokih temperaturah.
Topnost vode
Mešljiv ≥ 100 mg/ml pri 25 ° C
Topnost
Je topen v etru in alkoholih, vendar netopna v oljnem etru. Razpade v vodi in kisiku v mnogih organskih topilih.
Koeficient oktanola/vode
Dnevnik p = - 0,43
Parni tlak
5 mmHg pri 30 ° C.
Konstanta disociacije
PKA = 11,72
ph
Raztopine vodikovega peroksida so rahlo kisle. Na primer, eden do 35% ima pH 4,6; Ko pa se koncentrira na 90%, pH postane manj kisel: 5.1.
Indeks loma (nD)
1.4061
Goo
1.245 cpoise pri 20 ° C.
Toplotna zmogljivost
1,267 j/g · k (plin)
2.619 J/G · K (tekočina)
Toplota za uparjanje
1,519 j/g · k
Stabilnost
Stabilen pod priporočenimi pogoji. Dodatek acetanilida in kositrnih soli ga bolj stabilizira.
Korozija
Jedko
Razgradnja
Se razgradi z izpostavljenostjo svetlobi ali v prisotnosti oksidacije in zmanjšanja snovi. Razčlenjen je tudi s segrevanjem. Ko ga zasežejo, se sproščata voda in kisik in naklonjena povečanju pH in temperature, pa tudi s prisotnostjo encima Catlase.
Vam lahko služi: natrijev peroksid (NA2O2): struktura, lastnosti, uporabePovršinska napetost
80,4 DINS/CM A 20 ° C
Reaktivnost
H2Tudi2 Deluje kot oksidacijsko sredstvo v kislih raztopinah železovega železa (vera2+) Železovo železo (f3+); tudi oksidirajte sulfitni ion (tako32-) za sulfatni ion (tako42-).
V prisotnosti osnovnih raztopin lahko deluje tudi kot reducirajoče sredstvo, kar zmanjšuje na natrijev hipoklorit (NAOCL) in kalijev permanganat (kmno4) Z sproščanjem kisika.
Prijave
Beljenje
Vodikov peroksid se uporablja v papirni industriji pri beljenju celuloze in papirja, ki porabi večino svoje letne proizvodnje.
Razkužilo
Vodikov peroksid je nežen antiseptik, da se izognete majhni okužbi ran, prask in opeklin. Uporablja se tudi kot izpiranje ust in za lajšanje blagega draženja ust zaradi prisotnosti ustnikov ali gingivitisa.
Uporablja se tudi za razkuževanje površin, notranjost hladilnikov, vode in boj proti prekomerni rasti bakterij v vodnih sistemih in hladilnih stolpih. Vodikov peroksid sprošča radikale brez kisika, ki razgradijo onesnaževala.
Detergent
Vodikov peroksid se uporablja pri proizvodnji detergentov za beljenje oblačil, vključno z natrijevim karbonatom. Ta spojina je kompleks natrijevega karbonata in vodikovega peroksida, ki se raztopi v vodni ločitvi v njegovih sestavnih delih.
Kozmetična aplikacija
Razredčen vodikov peroksid se uporablja pri beljenju las, pred obarvanjem. Uporablja se tudi za beljenje zob kot del domače zobne kreme.
Pogonsko gorivo
Vodikov peroksid se uporablja kot monoporperant ali oksidacijsko komponento biproponske rakete. Razbije sproščanje kisika in vode, kar je omogočilo njegovo uporabo kot pogonsko gorivo.
Reakcijska celica se črpa s prisotnostjo katalizatorja, ki pospešuje omenjeno razgradnjo. Med tem nastajajo vodna para pri visoki temperaturi.
Ko se para izganja skozi vrzel, povzroči impulz. Podmornica V-80, zgrajena leta 1940, uporabljena v kisikovih turbinah, ki nastanejo iz vodikovega peroksida; imenovan Walter turbinski sistem.
Pridobivanje
Sprva smo vodikov peroksid dobili industrijsko s hidrolizo amonijevega persulfata, [(NH4)2S2Tudi8] ali elektroliza amonijevega bisulfata, NH4HSo4.
Vodikov peroksid dobimo industrijsko z uporabo antrakinona. Postopek se izvede v štirih fazah: hidrogenacija, filtracija, oksidacija, ekstrakcija in čiščenje.
Vam lahko služi: magnezijev fluorid: struktura, lastnosti, sinteza, uporabaHidrogenacija
Alquilantroquinona je hidrogenirana s prehodom vodikovega plina skozi vodik, napolnjen z glinico, in majhno količino katalizatorja (Paladium). Temperatura se vzdržuje pri 45 ° C s trajno vznemirjenostjo.
Alkindrokinon se pretvori v Alquiloantrahydroquinona in tetrahidroalkvilantrahidrokinon.
Filtracija
Vsebovana rešitev.
Oksidacija
Filtrirana raztopina oksidira tako.
Ekstrakcija in čiščenje
Raztopina z vodikovim peroksidom prečka stolpec ekstrakcije tekočine-tekočine. Voda teče skozi stolpec, raztopina z vodikovim peroksidom.
Voda doseže dno ekstraktorja s koncentracijo vodikovega peroksida med 25 in 35 % P/P. Nato ga očistimo z vakuumsko destilacijo do 30 % koncentracije vodikovega peroksida. Končno stabilizirano in shranjeno.
Tveganja
 Burni vodikov peroksid. Vir: Bobjgalindo [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Burni vodikov peroksid. Vir: Bobjgalindo [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Vodikov peroksid je jedko sredstvo, zato stik s kožo poleg začasnega beljenja povzroči hudo draženje (nadrejena slika). Prav tako lahko povzroči poškodbe oči, srbenje, salpt, rdečico in ampule.
Njegovo vdihavanje povzroči draženje v nosu, grlu in pljučih. Medtem lahko večkratna izpostavljenost povzroči skrajšanje bronhitisa, kašlja, flegma in dihanja. In kot da ne bi bilo dovolj, ustvarja tudi glavobol, Vahid, slabost in bruhanje.
Resna izpostavljenost vodikovemu peroksidu lahko povzroči kopičenje tekočine v pljučih, kar je znano kot pljučni edem: resno stanje, ki zahteva hitro zdravniško pomoč.
Uprava za varnost in zdravje (OSHA) je v delovnem okolju v 8 do uri v delovnem okolju vzpostavila največjo dovoljeno za vodikov peroksid 1 ppm v delovnem okolju. Ker pa gre za mutageno spojino, je treba izpostavljenost minimumu zmanjšati.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Vodikov peroksid. Pridobljeno iz: v.Wikipedija.org
- William R. Busing in Henri a. Dajatev. (2004). Kristalna in molekularna struktura vodikovega peroksida: študija difrakcije nevtrona -. doi.org/10.1063/1.1696379
- Nacionalni center za informacije o biotehnologiji. (2019). Vodikov peroksid. Baza podatkov Pubchem. Cid = 784. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Uredniki Enyclopeedia Britannica. (27. november 2018). Vodikov peroksid. Encyclopædia Britannica. Okrevano od: Britannica.com
- Ministrstvo za zdravje v New Jerseyju. (2016). Vodikov peroksid. [PDF]. Okreval od: NJ.Gov
- Mathews, c. K., Van Holde, k. In., Ahern, k. G. (2002). Biokemija. Tretja izdaja. Uredništvo Pearson Addison Wesley
- MD splet. (2019). Vodikov peroksid. Pridobljeno iz: webmd.com
- « Azteška zgodovina medicine, Bog, rastline, bolezni
- Struktura cinkovega oksida (ZnO), lastnosti, uporabe, tveganja »

