Pencanona Kemična struktura, lastnosti, sinteza, uporablja
- 1864
- 510
- Barry Ernser
The Pentanona Gre za organsko spojino, ki pripada družini ketonov, katere kemijska formula je c5H10Tudi. Ostaja eden najpreprostejših ketonov in je sestavljen iz brezbarvne tekočine z aromo, podobno kot pri acetonu. Od zdaj naprej, glede na ogljikovo število njihovega okostja, ketoni predstavljajo izomer.
Ko govorimo o položaju Isomeria, se nanaša na to, kje je karbonilna skupina, c = o. Tako je Puntanona dejansko sestavljena iz dveh spojin s fizikalnimi lastnostmi, ki se med seboj komaj razlikujejo: 2-unon in 3-Pone (spodnja slika). Obe sta tekoči, vendar so njihove vrelišča enake, zato jih ni mogoče ločiti z destilacijo.
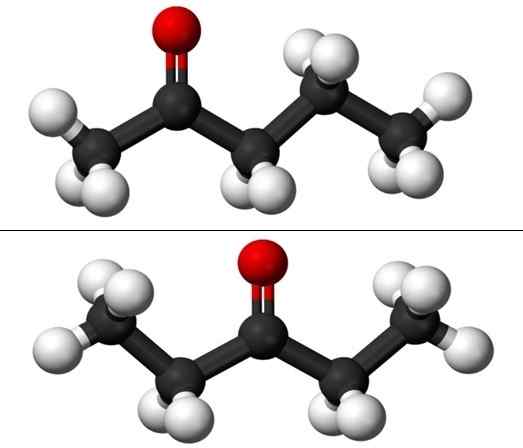
 Molekule položaja izomerov za Pentanono. Vir: Jynto & Ben Mills prek Wikipedije.
Molekule položaja izomerov za Pentanono. Vir: Jynto & Ben Mills prek Wikipedije. Vendar pa ima vsak od obeh pentanonov svojo sintezno pot, zato je malo verjetno, da je mešanica le -teh; mešanica, ki jo je mogoče ločiti z zamrzovanjem.
Njegova uporaba je omejena zlasti kot organska topila; Alternative acetonu v medijih, kjer delate s temperaturo, višjo od njene nizke vrelišča. Prav tako začenjajo materiale za drugo organsko sintezo, saj lahko njihova skupina C = O zmanjša ali utrpi nukleofilni dodatek.
[TOC]
Kemična struktura
Izomeri položaja
Na sliki imamo molekularne strukture obeh položajev izomerov za Puntanono, ki jih predstavlja model sfer in palic. Črne sfere ustrezajo gaziranim okostjem, atomom belih do vodikov in atomi rdečih kisika v skupini C = O.
2-pintanon
2-ponanona (zgoraj) ima skupino C = ali v drugem ogljiku, ki je enakovreden, če je bil v sobi; to pomeni, da sta 2-ponanona in 4-pantanona enakovredna, saj je dovolj, da jih zasukamo 180 °, tako da so njihove strukture enake.
Vam lahko služi: ogljikov tetraklorid (CCL4)Levo od c = o imate metil radikal, cho3-, In na njegovi desni, radikalni propad. Zato ta cetona dobi tudi ime (manj uporabljena) od MeTil Propil Cetona (MPK v angleščini). Asimetrijo te strukture lahko vidite na prvi pogled.
3-omalo
3-péntanona (spodaj) ima skupino C = o v tretjem ogljiku. Upoštevajte, da je ta izomer večja različica acetona in da je tudi zelo simetrična; Dva radikala na straneh skupine C = O sta enaka: dva etilna radikala, CH3Pogl2-. Zato se 3-pananona imenuje tudi Cetona Diestil (ali dimetil aceton).
Medmolekularne interakcije
Prisotnost karbonilne skupine, tako v 2-pantanonu kot v 3-Penoni, daje polarnost molekuli.
Zato lahko oba izomeri Pentanona medsebojno komunicirata prek dipole-dipola.
Prav tako se londonske disperzijske sile med ogljikom in hidrogeniranimi okostji v manjši meri posredujejo.
S tem prispevkom s Puntanono, večjo molekulsko površino in maso v primerjavi z acetonom, ta prispevek doda svoj dipolski trenutek in omogoča večjo vrelišče (102 ° C> 56 ° C), da ima večjo točko vrelišča). Pravzaprav oba izomera izhlapita pri 102 ° C; Medtem ko zamrznejo pri različnih temperaturah.
Kristali
Verjetno pri kristalizaciji igrajo simetrije pomembno vlogo. Na primer, fuzijska točka 2 -Pantanona je -78 ° C, medtem ko 3 -péntanona, -39 ° C.
Vam lahko služi: Avogadro LawTo pomeni, da so kristali 3-pantanona bolj stabilni proti temperaturi; Njegove molekule so bolj kohezivne in potrebujejo več toplote za ločitev v tekoči fazi.
Če bi obstajala mešanica obeh izomerov, bi bil 3-penon prvi, ki je kristaliziral, končno pa 2-pananona pri nižji temperaturi. Molekule 3-pantanona, bolj simetričnega, so usmerjene lažje kot tiste iz 2-ponanone: asimetrične in hkrati bolj dinamične.
Lastnosti
Fizični videz
Brezbarvne tekočine z aromo, podobno kot pri acetonu.
Molarna masa
86,13 g/mol
Gostota
0,81 g/ml (3-ponanona)
0,809 g/ml (2-ponanona)
Tališče
-78 ° C (2-ponanona)
-39 ° C (3-Ponanona)
Vrelišče
102 ° C (za oba izomera)
Topnost vode
35 g/l (3-ponenona)
60 g/l (2-ponenona)
Parni tlak
35 mmHg (3-ponenona)
270 mmHg (2-pantanon) pri 20 ° C
Te vrednosti niso koristne za neposredno primerjavo parnih tlakov obeh izomerov, saj se prvi poroča brez temperature, pri kateri je bila izmerjena.
Plamenišče
12,78 ° C (3-Ponanona)
10 ° C (2-ponanona)
Stabilnost
Dva izomeri Pentanona sta izjemno vnetljivi, zato morata ostati tako daleč od vsakega vira toplote. Flash točke kažejo, da lahko plamen nastavi hlape obeh pentanov tudi pri temperaturi 10 ° C.
Sinteza
Čeprav sta oba izomera Pentanona fizično in kemično zelo podobna, so njihove sintetične poti neodvisne od druge, zato je malo verjetno, da bi oba pridobljena v isti sintezi.
2-pintanon
Začenši iz 2-penolskega reagenta, sekundarnega alkohola, to lahko oksidiramo na 2-ponanon z uporabo hipoklorozne kisline, ki jo tvori in situ, HClo, kot oksidacijsko sredstvo. Oksidacija bi bila:
Lahko vam služi: brez elektrolitov: značilnosti in primeri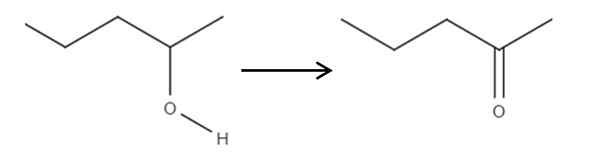 Oksidacija 2-pantanola pri 2-pantanoni. Vir: Gabriel Bolívar.
Oksidacija 2-pantanola pri 2-pantanoni. Vir: Gabriel Bolívar. Preprosto povezava C-OH postane C = O. Obstajajo tudi druge metode za sintezo 2-penone, vendar je to najpreprostejše razumeti.
3-omalo
3-pintanon je mogoče sintetizirati3Pogl2COOH. Ta sintetična pot proizvaja simetrične ketone in je, da je molekula CHO3COOH bo izgubil skupino COOH v obliki CO2, Medtem ko druga vaša skupina oh v obliki h2Eno:
2ch3Pogl2Cooh => ch3Pogl2Coch2Pogl3 + Co2 + H2Tudi
Druga nekoliko bolj zapletena pot je neposredno reagirati mešanico etilena, CHO2= Pogl2, Co2 in h2 Oblikovati 3-ponanona.
Prijave
Če je aplikacija zelo stroga, gre za specifično sintezo ali da se tudi dokazano, da oba izomeri ne povzročata enakih rezultatov, je nepomembno, da izbirate med uporabo 2-pogana ali 3-pogan v katerem koli od njegovih Uporaba.
To pomeni, da "ni pomembno", če želite uporabiti 2-ponanona ali 3-penona kot topilo slik ali smol ali kot bedno, ker bodo najpomembnejša merila postala njegova cena in razpoložljivost. 3-Poin se v avtomobilski industriji uporablja za preučevanje vedenja plinov znotraj motorjev za notranje zgorevanje.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Wikipedija. (2019). 3-kovč. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). 2-pontenone. Baza podatkov Pubchem. Cid = 7895. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Royal Society of Chemistry. (2019). 3-kovč. Okreval od: chemspider.com
- Profesor T. Nalli. (2013). Oksidacija 2-pintanola in destilacija izdelka. Okreval od: tečaj1.Winona.Edu

