Značilnosti oksihemoglobina, krivulja strukture in stičišča
- 4418
- 238
- Adrian Legros
TudiXihemoglobin To je ime, ki ga prejme hemoglobin, ko se pridruži kisiku. Hemoglobin je protein, ki je znotraj rdečih krvnih celic in katerih glavna funkcija je prevoz kisika iz pljuč v tkiva.
Prva živa bitja so bila enocelična in so živela v tekoči atmosferi, iz katere so jih hranili in do katere so odpravili svoje odpadke, pa tudi nekatere organizme, ki trenutno obstajajo. V teh pogojih se ti procesi dosežejo s preprostimi mehanizmi razširjanja, saj je celična stena v intimnem stiku s medijem, ki ga oskrbuje.
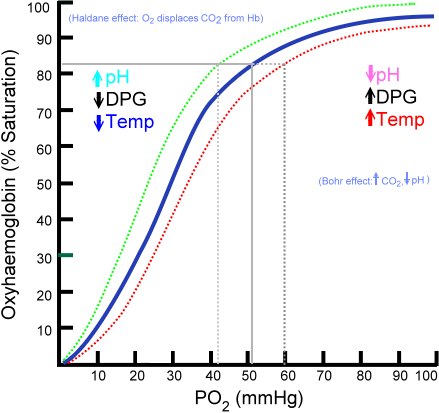
 Krivulja disociacije oksihemoglobina (vir: Ratznij pri angleških različicah Wikipedialata je naložil Aaronsharpe v In.Wikipedija. [Javna domena] prek Wikimedia Commons)
Krivulja disociacije oksihemoglobina (vir: Ratznij pri angleških različicah Wikipedialata je naložil Aaronsharpe v In.Wikipedija. [Javna domena] prek Wikimedia Commons) Razvoj vse bolj zapletenih množičnih organizmov je pomenil, da so se notranje celice znatno premaknijo od okolja, zato so mehanizmi razširjanja kot edinega vira oskrbe postali nezadostni.
Tako so bili razviti specializirani sistemi za pridobivanje hranil in plinov, kot so prebavni sistem in dihalni sistem, pa tudi transportne mehanizme, da bi ta hranila in pline pripeljali v celico: kardiovaskularni sistem.
Za proizvodnjo energije v obliki molekul ATP celice potrebujejo kisik. Glede na dejstvo, da ATP ni mogoče shraniti, ga je treba nenehno sintetizirati, kar pomeni trajno povpraševanje po kisiku s celicami.
Pojavil se je hemoglobin, evolucijsko gledano, kot transporter za plin, ki "rešuje" problem prevoza kisika iz okolja v celico.
[TOC]
Značilnosti in struktura
Če želite govoriti o značilnostih in strukturi oksihemoglobina, se je treba sklicevati na hemoglobin, saj oksihemoglobin ni nič drugega kot kisik hemoglobin. Zato bodo od zdaj naprej opisane skupne značilnosti molekule v prisotnosti ali ne.
Za kaj je hemoglobin?
Hemoglobin je potreben za prevoz kisika v tkiva v količini in hitrosti, ki si jih zaslužijo, glede na dejstvo, da ima kisik tako malo topnosti krvi, da njegov difuzijski transport ne bi bil dovolj za oskrbo s potrebami po tkivih.
Vam lahko služi: dokazi evolucije živih bitijKako je molekula hemoglobina?
Hemoglobin je tetramerični protein (ki ima štiri podenote), ima sferično obliko in molekulsko maso 64 kDa.
Njegove štiri podenote predstavljajo eno samo funkcionalno enoto, kjer vsaka vzajemno vpliva na drugo. Vsaka podenota je sestavljena iz polipeptidne verige, globin in protetične skupine, skupine hemo ali "hem", ki deluje kot kofaktor in je ne tvori aminokislin; to pomeni, da ni beljakovinska narava.
Globin je na dva načina: Alpha Globin in Beta Globin. Tetramer hemoglobina je sestavljen iz parov alfa globinskih verig (141 aminokislin) in nekaj verig beta globusa (146 aminokislin).
Vsaka od štirih polipeptidnih verig je povezana s hemo skupino, ki ima v središču železov atom v železovem stanju (Fe2+).
Kako je s hemo?
Hemo skupina je porfirinski obroč, ki ga tvorijo štirje pirolični obroči (heterociklične aromatične spojine s formulo C4H5N), združene z metilnimi mostovi. Železo v železovem stanju, ki ga najdemo v središču.
Vsaka hemo skupina se lahko pridruži molekuli kisika, tako da se lahko vsaka molekula hemoglobina pridruži le 4 molekuli plina.
Človeško telo vsebuje približno 2,5 x 1013 eritrocitov, ki so krvne celice, ki proizvajajo in prenašajo hemoglobin. Vsak eritrocit ima približno 280 milijonov molekul hemoglobina in nato lahko prevaža več kot 1000 milijonov molekul kisika.
Vam lahko služi: postopek hominizacije: značilnosti in fazeKako se tvori oksihemoglobin?
Oksihemoglobin nastane po združitvi atoma kisika do vsakega železovega atoma železa, ki ga najde v vsaki hemo skupini molekule hemoglobina.
Izraz oksihemoglobin se nato nanaša na oksigeniran in ne kemično oksidiran hemoglobin, saj ne izgubi elektrona, če v kombinaciji s kisikom in železom ostane v železovem stanju.
Oksigenacija povzroči spremembo kvartarne strukture molekule, to je sprememba konformacije, ki jo je mogoče prenesti iz globinskih verig v hemo in obratno skupino.
Kakšna je največja količina kisika, ki lahko naloži hemoglobin?
Hemoglobin se lahko v svoji strukturi pridruži štirim molekulam kisika. Če je molarna prostornina idealnih plinov 22.4 L/mol, en mol hemoglobina (64.500G) se bo pridružil z 89.6 litrov kisika (4 moli O2 x 22.4 l/mol).
Torej, vsak gram hemoglobina se mora pridružiti 1.39 ml O2 je 100% nasičeno (89.6L/64500G x (1000ml/L)).
V praksi krvni testi kažejo nekoliko nižje rezultate, saj obstajajo majhne količine methemoglobina (oksidirani hemoglobin) in karboksihemoglobina (hemoglobin + ogljikov monoksid (CO)), ki se ne morejo pridružiti kisiku.
Če upoštevamo to, pravilo "Hüfner" ugotovi, da ima v krvi 1 g hemoglobina največjo sposobnost združevanja kisika 1.34ml.
Krivulja vezave oksihemoglobina
Količina molekul kisika, ki jih je mogoče pridružiti molekuli hemoglobina, je odvisna od delnega tlaka kisika ali PO2. Če kisika ni, se hemoglobin deoksigenira, vendar ko se PO2 povečuje, se število kisika, ki se veže na hemoglobin, poveča.
Proces vezave kisika na hemoglobin, odvisen od delnega kisikovega tlaka. Pri grafikonu se rezultat imenuje "oksihemoglobinska krivulja" in ima značilno obliko 's' ali sigmoida.
Vam lahko služi: taxizemOdvisno od PO2 bo hemoglobin v manjši ali večji zmogljivosti, da "sprosti" ali "dostavi" kisik, ki ga prenaša, in nalaganje s tem.
Na primer, v regiji med 10 in 60 mmHg pritiska dobite del z več do krivulje. V tem stanju lahko hemoglobin zlahka prinese velike količine O2. To je stanje, ki ga dosežemo v tkivih.
Kadar je PO2 med 90 in 100 mmHg (12 do 13 kPa), je hemoglobin skoraj 100% nasičen z O2; In ko je arterijski PO2 60 mmHg (8 kPa), je nasičenost z O2 še vedno višja od 90%.
V pljučih so to pogoji, ki prevladujejo (tlak med 60 in 100 mmHg), in to je, da omogočajo molekule hemoglobina, prisotne v eritrocitih.
Ta sigmoidna oblika, ki nariše krivuljo oksihemoglobina, zagotavlja, da se ta protein obnaša kot odličen polnilnik na pljučni ravni, zelo učinkovit transporter v krvnem tlaku in odličen darovalec O2 v tkivih, sorazmerno z lokalno hitrostjo presnove, torej zahtevati.
Reference
- Lisica, s. Yo. (2006). Človeška fiziologija 9. izdaja (str. 501-502). McGraw-Hill Press, New York, ZDA.
- Murray, r. K., Granner, d. K., Mayes, str. Do., & Rodwell, v. W. (2014). Harperjeva ilustrirana biokemija. McGraw-Hill.
- Rawn, j. D. (1998). Biokemija (1989). Burlington, Severna Karolina: Neil Patterson Publishers (C) N. Lalioti, cp raptopoulou, a. Terzis, a. Panagiotopoulos, sp perlepes in. Maness-Zouopa, j. Kem. Soc. Dalton Trans, 1327.
- Robert m. Berne, Matthew N. Dajatev. (2001) Fiziologija. (3. izd.) Harcourt Editions, s.Do.
- Zahod, J. B. (1991). Fiziološka osnova medicinske prakse. Williams & Wilkins
- « Značilnosti eritropoetina (EPO), proizvodnja, funkcije
- Značilnosti, struktura in funkcije distrofina »

