Značilnosti, struktura, funkcije, primeri oksidOrReductaze
- 823
- 70
- Don Nitzsche
The Oksidreduktaze So beljakovine z encimsko aktivnostjo, ki so zadolžene za kataliziranje reakcij zmanjšanja rje, to je reakcij, ki pomenijo odstranjevanje atomov vodika ali elektronov v podlagah, na katerih delujejo.
Reakcije, ki jih te encimi katalizirajo, kot že ime pove, so oksidno-redukcijske reakcije, to je reakcije, kjer molekula podari elektrone ali vodikove atome in jih prej.
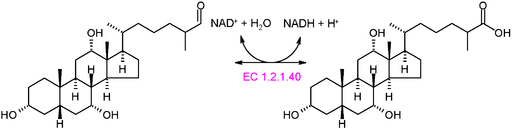 Grafična shema reakcije oksidortaze tipa EC 1.2.1.40 (vir: akane700 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons)
Grafična shema reakcije oksidortaze tipa EC 1.2.1.40 (vir: akane700 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons) Primer zelo pogostih oksidortičnih encimov v naravi je dehidrogenaze in oksidaze. Lahko bi ga omenili encimu alkoholne dehidrogenaze, ki katalizira dehidrogenacijo etanola, da nastane acetaldehid v odvisnosti.
Encimi elektronske transportne verige v aerobnih celicah so oksidortas, ki zadolžujejo črpanje protonov, zato ustvarjajo elektrokemični gradient skozi notranjo mitohondrijsko membrano, ki omogoča povečanje sinteze ATP.
[TOC]
Splošne značilnosti
Encimi oksidoreduktaze so encimi, ki katalizirajo oksidacijo spojine in sočasno zmanjšanje drugega.
Ti običajno zahtevajo prisotnost različnih vrst koencimov za njihovo delovanje. Koencimi izpolnjujejo funkcijo darovanja ali sprejemanja.
Ti koencimi so lahko navora NAD+/NADH ali navora FAD/FADH2. V številnih aerobnih presnovnih sistemih se ti elektroni in vodikovi atomi sčasoma prenesejo iz koencimov v kisik.
So encimi z izrazito "pomanjkanje" specifičnosti substrata, kar jim omogoča, da katalizirajo navzkrižne reakcije v različnih vrstah polimerov, ne glede na to, ali gre za beljakovine ali ogljikove hidrate.
Klasifikacija
Velikokrat nomenklatura in klasifikacija teh encimov temeljita na glavnem substratu, ki ga uporabljajo, in na vrsto koencima, ki ga potrebujejo za delovanje.
Glede na priporočila Nomenklaturnega odbora Mednarodne unije za biokemijo in molekularno biologijo (NC-IBMB).C. 1 in vključujejo več ali manj 23 različnih vrst (e.C.1.1-e.C.1.23), ki so:
Vam lahko služi: eritropoetin (EPO): značilnosti, proizvodnja, funkcije- In.C. 1.1: ki delujejo v skupinah donatorjev CH-OH.
- In.C. 1.2: Kateri delujejo v skupini Aldehida ali v skupini darovalcev Oxo de los.
- In.C. 1.3: ki delujejo v skupinah donatorjev ch-ch.
- In.C. 1.4: ki delujejo v skupinah donatorjev CH-NH2.
- In.C. 1.5: Kateri delujejo v skupinah donatorjev CH-NH.
- In.C. 1.6: Kateri akt v Nadhu ali NADPH.
- In.C. 1.7: ki delujejo na druge dušikove spojine, kot so donatorji.
- In.C. 1.8: ki delujejo na žveplove skupine donatorjev.
- In.C. 1.9: ki delujejo v hemo skupinah darovalcev.
- In.C. 1.10: ki delujejo pri donatorjih, kot so difenoli in druge povezane snovi.
- In.C. 1.11: ki delujejo na peroksid kot sprejemnik.
- In.C. 1.12: ki delujejo na vodik kot darovalec.
- In.C. 1.13: ki delujejo na preproste darovalce z vključitvijo molekularnega kisika (oksigenaze).
- In.C. 1.14: ki delujejo na "seznanjene" darovalce, z vključitvijo ali zmanjšanjem molekularnega kisika.
- In.C. 1.15: ki delujejo na superokside kot sprejemniki.
- In.C. 1.16: ki oksidira kovinske ione.
- In.C. 1.17: Kateri delujejo v skupinah CH2.
- In.C. 1.18: ki delujejo na beljakovine, ki vsebujejo železo in prevzemajo kot darovalce.
- In.C. 1.19: Kateri delujejo na zmanjšanem flavodoksinu kot darovalcu.
- In.C. 1.20: ki delujejo na darovalce, kot sta fosfor in arzen.
- In.C. 1.21: ki delujejo v reakciji x-h + y-h = x-y.
- In.C. 1.22: Kateri delujejo na halogenu donatorjev.
- In.C. 1.23: ki zmanjšujejo skupine C-O-C kot sprejemnike.
- In.C. 1.97: Druge oksidoryductaze.
Vsaka od teh kategorij vključuje tudi podskupine, v katerih so encimi ločeni glede na prednostno podlago.
Vam lahko služi: primarno nasledstvo: značilnosti in primeriNa primer, znotraj skupine oksidoreduktaz, ki delujejo na skupini CH-OH svojih darovalcev, obstajajo nekateri, ki imajo raje NAD+ ali NADP+ kot sprejemniki, drugi pa uporabljajo citokrome, kisik, žveplo itd.
Struktura
Ker je skupina oksidoreduktaze izjemno raznolika, je vzpostavitev določene strukturne značilnosti precej zapletena. Njegova struktura se ne razlikuje le od encima do encima, ampak tudi med vrstami ali skupinami živih bitij in celo celice do celice v različnih tkivih.
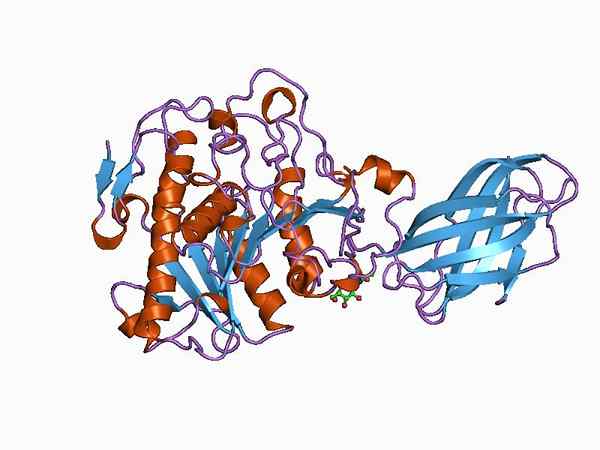
 Bioinformatični model strukture encima oksiduktaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons)
Bioinformatični model strukture encima oksiduktaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) The enzyme pyruvate dehydrogenase, for example, is a complex composed of three sequentially linked catalytic subunits and known as the E1 subunit (dehydrogenase piruvate), the E2 subunit (dihydrolipamide acetyltransferase) and the E3 subunit (dihydrolipamide dehydrogenase).
Vsaka od teh podenot je lahko sestavljena iz več kot enega beljakovinskega monomera iste vrste ali različnih vrst, to je, da so lahko homodimerne (tiste z samo dvema enakimi monomeri), heterotrimérica (ki imajo tri monomere različne) in tako naprej.
Vendar so običajno encimi, sestavljeni iz alfa dvoran in β-pločevink, razporejenih v različnih oblikah, s specifičnimi intermolekularnimi interakcijami različnih vrst različnih vrst.
Funkcije
Oksidortirani encimi katalizirajo reakcije redukcije oksida praktično v vseh celicah vseh živih bitij na biosferi. Te reakcije so na splošno reverzibilne, v katerem se spremeni oksidacijsko stanje enega ali več atomov znotraj iste molekule.
Običajno oksidorestoni potrebujejo dva substrata, enega, ki deluje kot darovalec vodika ali elektronov (ki oksidira), in drugega, ki deluje kot sprejemnik vodika ali elektronov (ki se zmanjša).
Ti encimi so izredno pomembni za številne biološke procese v različnih vrstah celic in organizmov.
Delujejo na primer v sintezi melanina (pigmenta, ki nastane v celicah kože ljudi), pri tvorbi in razgradnji lignina (strukturna spojina rastlinskih celic), pri zlaganju beljakovin itd.
Lahko vam služi: vrste, predstavljene na otokih GalapagosIndustrijsko se uporabljajo za spreminjanje teksture nekaterih živil, primer pa so peroksidaze, glukoza oksidaze in drugi.
Poleg tega so najpomembnejši encimi te skupine tisti, ki sodelujejo kot elektronski transporterji v tekočih verigah mitohondrijske membrane, kloroplasti in notranje plazemske membrane bakterij, kjer so transmembranalne beljakovine.
Primeri oksidortas
Obstaja na stotine primerov oksidortiranih encimov v naravi in industriji. Ti encimi imajo, kot že omenjeno, funkcije izjemnega pomena za celično delovanje in zato za življenje po sebi.
Oksiduktaze ne vključujejo samo encime peroksidaze, lak, glukozo oksidaze ali dehidrogeni alkohol; Združujejo tudi pomembne komplekse, kot je gliceraldehid encim 3-fosfat dehidrogenaza ali komplimenus dehidrogenaza itd., bistvenega pomena z vidika glukozne katabolizma.
Vključuje tudi vse encime elektronskega transportnega kompleksa v notranji mitohondrijski membrani ali v notranji membrani bakterij, podobno kot nekateri encimi, ki jih najdemo v kloroplastih rastlinskih organizmov.
Peroksidaze
Peroksidaze so zelo raznoliki encimi in uporabljajo vodikov peroksid kot sprejemnik elektronov za kataliziranje oksidacije različnih substratov, vključno s fenoli, amini ali tioli. V svojih reakcijah zmanjšujejo vodikov peroksid, dokler ne proizvaja vode.
Z industrijskega vidika so zelo pomembni, saj je peroksidaza začinjene redkvice najpomembnejša in najbolj raziskana od vseh.
Biološko gledano so peroksidaze pomembne za odpravo reagentnih kisikovih spojin, ki lahko povzročijo znatno škodo na celicah.
Reference
- Britannica Encyclopeedia. (2019). Pridobljeno 26. decembra 2019 z www.Britannica.com
- Ercilici-cura, d., HUPPERZ, t., & Kelly, a. L. (2015). Encimska sprememba teksture mlečnih izdelkov. Pri spreminjanju teksture hrane (pp. 71-97). Založba Woodhead.
- Mathews, c. K., Van Holde, k. In., & Ahern, k. G. (2000). Biokemija. Dodaj. Wesley Longman, San Francisco.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.
- Nomenklaturni odbor Mednarodne zveze za biokemijo in molekularno biologijo (NC-IBMB). (2019). Pridobljeno z www.Qmul.AC.UK/SBCS/IUBMB/ENZIM/INDEX.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, f. (2014). Kompleksi piruvata dehidrogenaze: funkcija in regulacija strukture. Časopis za biološko kemijo, 289 (24), 16615-16623.

