Koordinacijska številka, kaj je, izračun, primeri

- 4889
- 151
- Don Nitzsche
On Koordinacijska številka Količina atomov, ionov ali molekul medsebojno deluje s središčem v ionskih in koordinacijskih spojinah. Ta koncept je mogoče uporabiti tudi za molekule, ob upoštevanju, koliko atomov je med seboj povezanih namesto števila njihovih povezav.
Ta številka je pomembna, ker definira geometrije kompleksov, gostoto njihovih materialnih faz in celo stereokemični (prostorski) značaj njihovih reaktivnosti. Da bi poenostavili svojo definicijo, se štejejo za soseda na vseh atomu, ki obdaja določeno središče.
 Na področju kovancev lahko cenimo tisto, kar pomeni koordinacijska številka
Na področju kovancev lahko cenimo tisto, kar pomeni koordinacijska številka Razmislite na primer tla, sestavljena iz kovancev zgornje slike. Vsi kovanci so enake velikosti, in če je vsaka opažena, jih obdaja šest drugih; to pomeni, da imajo šest sosedov in zato koordinacijsko številko (c.N.) Za kovance je 6. Ta ista ideja se zdaj razširi na tri dimenzionalni prostor.
Če so njihovi radijski sprejemniki neenaki, ne bodo vsi imeli enake koordinacijske številke. Na primer: večja kot je valuta, več sosedov bo lahko interakcijo z večjim številom kovancev okoli njega. Z majhnimi kovanci se zgodi nasprotno.
[TOC]
Koncept številke koordinacije
VS ionski radijski sprejemniki. Koordinacijska številka
Koordinacijska številka je število najbližjih sosedov in ki načeloma neposredno komunicirajo s centrom, ki je večinoma kovinski ion. Torej, odložimo kovance, da bi namesto tega razmislili o kroglah.
Ta kovinski ion mn+, kje n Je enak njegovi oksidaciji ali valenciji, deluje z drugimi sosedi (ionskimi ali molekularnimi), imenovanimi ligandi. Višje je n (+2, +3 itd.), manjši bodo mn+ In posledično se bodo ligandi prisiljeni približati bolj interakciji z Mn+.
Vam lahko služi: maščoba maščobe: pridobivanje, vrste, sestava, uporabe, koristiNaslednja slika prikazuje zgoraj:
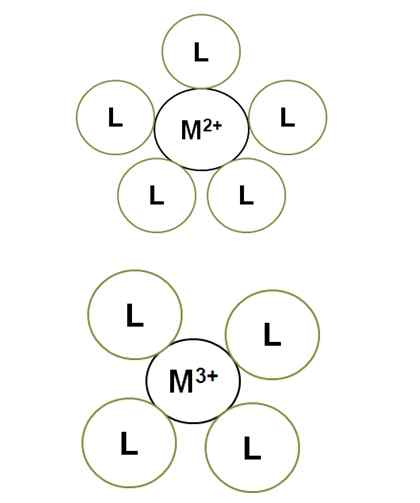 Sprememba koordinacijske številke z obremenitvijo centralnega iona. Vir: Gabriel Bolívar.
Sprememba koordinacijske številke z obremenitvijo centralnega iona. Vir: Gabriel Bolívar. M2+ V razsvetljenem kompleksu ima koordinacijsko številko 5: obkroža ga 5 ligandov l. Medtem, m3+ ima 4 koordinacijsko številko. To je zato, ker m3+, Za večjo velikost obremenitve se njegov polmer pogodbe in zato se morajo vezivi približati več, kar povečuje njihove elektronske odbojnosti.
Zato zajetni osrednji ioni, na primer tisti, ki pripadajo blokiranju kovin F, ali do drugega ali tretjega obdobja bloka d, Ponavadi imajo višje koordinacijske številke (c.N. > 6).
Gostote
Recimo zdaj, ko je m kompleks3+ je pod pritiskom. Prispela bo točka, kjer bo tlak takšen, da je druga povezava verjetno usklajena ali interakcija z M3+. To pomeni, da se bo njegova koordinacijska številka povečala s 4 na 5.
Na splošno pritiski povečujejo koordinacijske številke, saj se sosedje med seboj silijo na osrednji ion ali atom. Posledično materialne faze teh snovi postanejo gostejše, bolj kompaktne.
Geometrije
Višje ilustracije ne povedo ničesar o geometrijah okoli m2+ ali m3+. Vendar vemo, da ima kvadrat štiri točke ali vogale, tako kot tetrahedron.
Ta sklepanje je sklenjeno, da je geometrija okoli m3+, čigar c.N. Je 4, mora biti tetraedra ali kvadratna. Toda kdo od obeh? Medtem geometrije za m2+, čigar c.N. Je 5, lahko so kvadratna piramida ali trigonalna bipiramidalna.
Vsak c.N. Povezala je več možnih geometrij, ki postavljajo vezivo na ugodni razdalji, tako da je med njimi najmanjši odboj.
Vam lahko služi: interatomske povezaveKako se izračuna ali določi koordinacijska številka?
Koordinacijsko številko je mogoče izračunati, včasih neposredno iz zadevne sestavljene formule. Recimo anionski kompleks [ni (CN)5]3-. Kakšna je koordinacijska številka za nikljev ion ali2+? Dovolj je, da opazujemo stehiometrični koeficient 5, kar kaže, da je 5 anionov CN- Koordinirano ali interakcijo s središčem Ni2+.
Vendar ni vedno enostavno. Na primer, zdi se, da ima CUCN spojina koordinacijsko številko 1 za Cu2+ Kar zadeva CN-. Vendar je sestavljen iz dejansko Cu-CN-CU-CN polimernih verig, zato je pravilna koordinacijska številka 2.
Zato je zaželeno koordinacijsko številko, da jo določite, namesto da bi jo izračunali. Kot? Določitev ionskih ali molekulskih struktur spojin. To je mogoče zahvaljujoč instrumentalnim tehnikam, kot so X -ray difrakcija, nevtroni ali elektroni.
Primeri koordinacijskih številk
Naslednje in končno nekaj primerov spojin bo omenjeno za vsako najpogostejšo koordinacijsko številko. Prav tako bo rečeno, kakšne so njihove geometrije.
C.N. 2
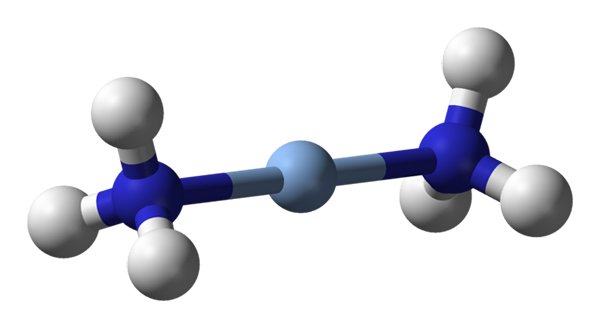 Tu opazimo linearno geometrijo [Ag (NH3) 2]+. Vir: Benjah-BMM27 / javna domena
Tu opazimo linearno geometrijo [Ag (NH3) 2]+. Vir: Benjah-BMM27 / javna domena A c.N. Enako 2 pomeni, da ima centralni atom ali ion samo dva soseda. Zato o spojinah obvezno govorimo o linearnih geometrijah. Med njimi imamo:
-Hg (pogl3)2
-[AG (NH3)2]+
-Ph3Paucl
C.N. 3
 Vsak atom ogljika v tem listu grafita je povezan s tremi drugimi, tako da ima tri sosede. Vir: Benjah-BMM27 / javna domena
Vsak atom ogljika v tem listu grafita je povezan s tremi drugimi, tako da ima tri sosede. Vir: Benjah-BMM27 / javna domena A c.N. Enako 3 pomeni, da je osrednji atom ali ion obkrožen s tremi sosedi. Nato imamo geometrije, kot so: trigonalna (trikotna) ravnina, trigonalna piramida in T oblika. Primeri spojin s to koordinacijsko številko so:
Lahko vam služi: atomska masa: definicija, vrste, kako jo izračunati, primeri-[Cu (CN)3]2-
-[PT (PCY3)3], Kjer se Pcy nanaša na liciloheksilofin ligand
-Grafit
C.N. 4
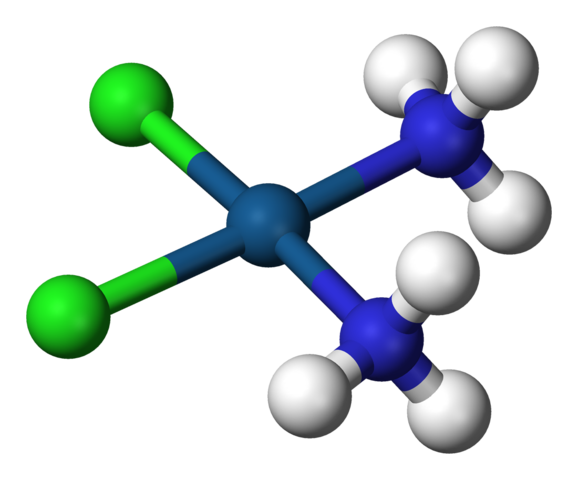 Kvadratna geometrija cisplatina, cis-ptcl2 (NH3) 2. Vir: Benjah-BMM27 / javna domena
Kvadratna geometrija cisplatina, cis-ptcl2 (NH3) 2. Vir: Benjah-BMM27 / javna domena A c.N. Enako 4 pomeni, da je osrednji atom ali ion obkrožen s štirimi sosedi. Možne geometrije so tetraedra ali kvadratne. Primeri spojin s to koordinacijsko številko imajo naslednje:
-Pogl4
-Cocl2Pyr2
-Cis-ptcl2(NH3)2
-[ALCL4]-
-[Moo4]2-
-Sncl4
-[CRO4]2-
-[Mno4]2-
Vsi ti primeri, z izjemo cis-ptcl2(NH3)2, So tetraedrske geometrije.
C.N. 5
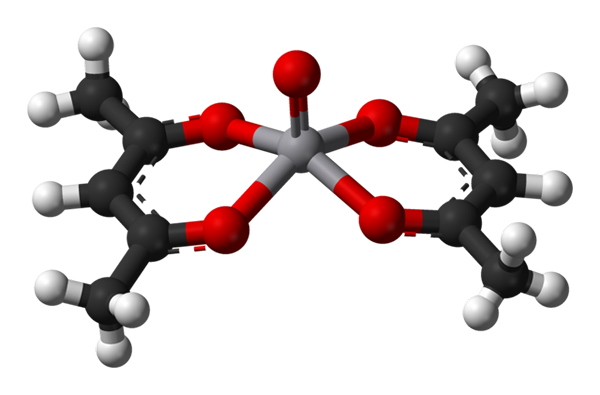 Kvadratna geometrija piramide za VO (ACAC) 2. Vir: Benjah-BMM27 / javna domena.
Kvadratna geometrija piramide za VO (ACAC) 2. Vir: Benjah-BMM27 / javna domena. A c.N. Enako 5 pomeni, da je atom ali centralni ion usklajen ali interakciji s petimi sosedi. Njegove že omenjene geometrije so kvadratna piramida ali trigonalna bipiramidalna. Kot primeri imamo naslednje:
-[Cobrn (Ch2Pogl2Nme2)3]
-[Fe (CO)5]
-Vo (acac)2, ACAC je acetilacetonatni ligand
C.N. 6
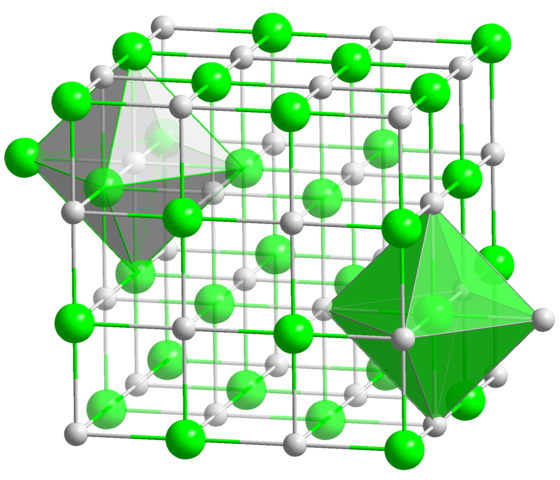 V kristalni strukturi NaCl ima vsak Na+ ion in Cl- šest sosedov, tako da je to koordinacijska številka za oba iona (glej oktaedre). Vir: trdna država / javna domena
V kristalni strukturi NaCl ima vsak Na+ ion in Cl- šest sosedov, tako da je to koordinacijska številka za oba iona (glej oktaedre). Vir: trdna država / javna domena To je daleč najpogostejša koordinacijska številka med vsemi spojinami. Ne pozabite na primer načelnih kovancev. Toda namesto njene najljubše geometrije je ravno šesterokotnike, ki oktaedra ustreza (normalni ali popačen), poleg trigonalne prizme. Nekateri številni primeri spojin s to koordinacijsko številko so:
-[ALF6]3-
-[CO (NH3)6]3+
-[ZR (izberite3)6]2-
-NaCl (ja, namizna sol)
-Mos2, Upoštevajte, da c.N. Za to spojino ni 2
Drugi
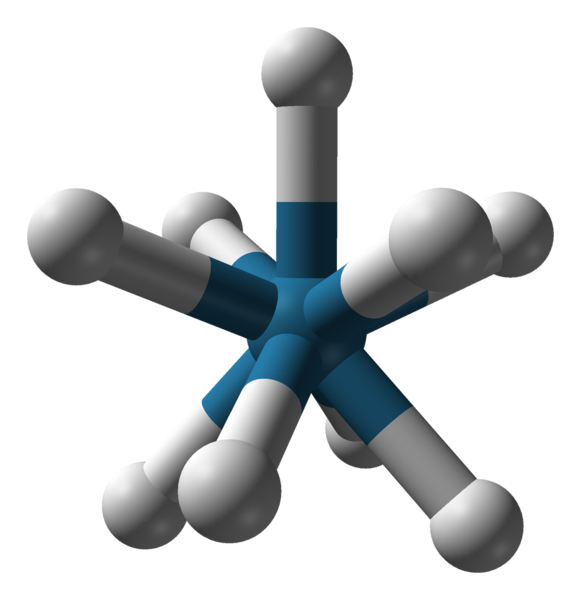 Tripadirana triapadična prizma geometrija aniona [reh9] 2-. Vir: Benjah-BMM27 / javna domena.
Tripadirana triapadična prizma geometrija aniona [reh9] 2-. Vir: Benjah-BMM27 / javna domena. Obstajajo druge koordinacijske številke, od 7 do 15. Tako da c.N. biti visok, osrednji ion ali atom mora biti zelo velik, ima malo obremenitve, hkrati pa morajo biti ligandi zelo majhni. Nekaj primerov spojin s takim c.N. So spodaj in končajo:
-K3[NBOF6], C.N. 7 in oktaedro geometrija
-[MO (CN)8]3-
-[ZR (Ox)4]2-, biti vol oksalatni ligand
-[Reh9]2-
-[Namrščeno3)6]2-, C.N. enako 12
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Koordinacijska številka. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (s.F.). Koordinacijska številka. Okrevano od: Britannica.com
- Prof. Robert J. Lancashire. (15. avgust 2020). Koordinacijske številke in geometrija. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (28. avgust 2020). Opredelitev številke koordinacije v kemiji. Okreval od: Thoughtco.com

