Struktura, lastnosti in uporabe kalijevega nitrita (KNO2)

- 4558
- 42
- Stuart Armstrong
On Kalijev nitrit Je anorganska sol, katere kemijska formula je podobna2, ki je kemično in farmakološko povezan s kalijevim nitratom3. Njegov fizični videz je sestavljen iz rumenkasto belih kristalov, zelo higroskopskih in zato delic; to pomeni, da se v vlažnih okoljih hitro raztopijo.
Njegova formula kaže, da je delež K ionov+ in ne2- Je 1: 1 in ostanejo združene z elektrostatičnimi silami ali ionske povezave. Čisti naravni viri očitno niso našli za svoje kristale, čeprav lahko niter anione najdemo v tleh, gnojilih, rastlinah in živalih.
 Kalijevi Nitalni kristali. Vir: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Kalijevi Nitalni kristali. Vir: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Zgornja slika prikazuje, kako izgledajo Knovi kristali2, Z izrazitimi rumenimi toni. Če so ti kristali v stiku z zrakom, bodo absorbirali vlago, da bodo postali vodna raztopina; rešitev, ki je ustvarila polemike glede na to, ali je njegova uporaba koristna ali ne.
Po drugi strani se njeni kristali pod zelo majhnimi količinami (200 ppm) uporabljajo za salinizacijo mesa in zagotavljanje njihovega ohranjanja proti bakterijskim delovanjem. Tudi kno2 Izboljša barvo mesa in jih bolj rdečkasto spremeni; Vendar pa je predmet več omejitev, da se izognemo strupenim učinkom te soli na telo.
[TOC]
Struktura kalijevega nitrita
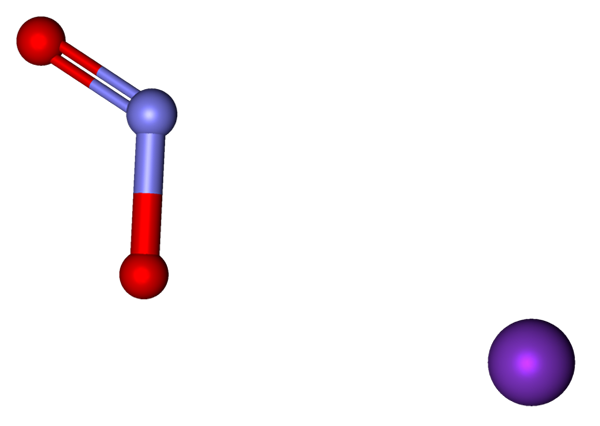 Ioni, ki sestavljajo KNO2, predstavljeni z modelom kroglic in palic. Vir: Marinavladivok [CC0].
Ioni, ki sestavljajo KNO2, predstavljeni z modelom kroglic in palic. Vir: Marinavladivok [CC0]. Ioni, prisotni v kalijevem nitritu, so prikazani zgoraj. Kation k+ ustreza vijolični sferi, anion pa ne2- Predstavljajo ga modrikaste in rdeče sfere.
Anion št2- Prikazan je z dvojno vezjo in preprosto [o = n-o]-; Toda v resnici sta obe povezavi enaki kot posledica resonance negativne obremenitve med njimi.
K ioni+ in ne2- V vesolju pritegnejo drug drugega, da organizirajo strukturni vzorec z najmanj energije; To je, kjer so odbojnosti med enakimi obremenitvami minimalne. In tako verjamejo kno kristali2, katere enotna celica je dovzetna za temperaturne spremembe, katere fazne prehode.
Vam lahko služi: Stanislao CannizzaroNa primer pri nizkih temperaturah (manj kot 25 ° C) Kno kristali2 sprejeti monoklinični sistem (faza I). Ko temperatura presega 25 ° C, pride do romboébičnega monokliničnega faznega prehoda (faza II). Končno, nad 40 ° C Kno kristali2 Sprememba v kubično (faza III).
Tudi kno2 lahko kažejo druge kristalne faze (faze IV, V in VI) pod visokimi pritiski. S tem, k ioni+ in ne2- Na koncu se premikajo in uredijo na različne načine v svojih čistih kristalih.
Lastnosti
Molekularna masa
85.1038 g/mol.
Gostota
1.9150 g/ml.
Tališče
440,02 ° C (vendar se začne razpadati s 350 ° C, oddaja strupene hlape).
Vrelišče
537 ° C (eksplozija).
Topnost vode
312 g/ 100 g vode pri 25 ° C.
Delicuescence
Njegova topnost v vodi je takšna, da je higroskopska; Toliko, da ima delikosknost, ki absorbira dovolj vlage, da se raztopi. Ta afiniteta do vode je lahko posledica energijske stabilnosti, ki jo pridobijo K ioni+ Pri hidriranju, pa tudi entalpija z nizko kristalno omrežje za kristale KNO2.
Kristali lahko absorbirajo vodo, ne da bi se raztopili, da bi postali hidrat2· H2Tudi. Pri hidratu spremlja molekula vode, ki spreminja kristalno strukturo.
Ta hidrat (ali več njih) se lahko oblikuje pod -9 ° C; Pri višji temperaturi voda raztopi in hidrira ione, deformira kozarec.
Topnost v drugih topilih
Rahlo topno v vročih alkoholih in zelo topno v amoniaku.
ph
6-9. Njene vodne raztopine so torej alkalne, saj anion ne2- Lahko hidrolizira.
Nomenklatura
K kno2 Lahko ga poimenujemo tudi na druge načine. "Kalijev nitrit" ustreza imenu za to sol v skladu z nomenklaturo zalog; "Kalijev nitrito", glede na sistematično nomenklaturo, v kateri je poudarjena edina valenca kalija, +1; in dioksonitrat (III) kalija v skladu s sistematično nomenklaturo.
Lahko vam služi: dibenzalacetona: lastnosti, reakcijski mehanizem, uporabe, tveganjaKalijev 'dioksonitrat (III), poudarja valenco +3 dušikovega atoma. Celo ime, ki ga najbolj priporoča IUPAC za kno2, "Kalijev nitrit" je še vedno najbolj udoben in najlažji si ga zapomniti.
Pridobivanje
Najbolj neposreden način za sintezo, vendar z nižjo zmogljivostjo, je s toplotnim razpadom kalijevega nitrata ali soline pri 400 ° C ali več:
2kno3 => Kno2 + Tudi2
Vendar del kno2 konča razpadanje s toploto, poleg drugih izdelkov.
Druga metoda za pripravo ali sintezo z večjo zmogljivostjo je z zmanjšanjem KNO3 V prisotnosti svinca, bakra ali cinka. Enačba za to reakcijo je naslednja:
Kno3 + Pb => kno2 + Pbo
Kalijev in svinčev nitrat se stehiometrično mešata v železni ponvi, kjer se združita s stalno vznemirjenostjo in segrevanjem pol ure. Svinčevi oksid (II) je rumen, nastalo testo pa je vroče in obdelano z vrelo vodo. Nato vroča mešanica filtrira.
Vroče filtrirne mehurčke z ogljikovim dioksidom pet minut, kar bo dalo svinčeno karbonat, PBCO3, nerešljiv. Na ta način je svinčeno vodstvo končano. Dušikova kislina, razredčena na filtriranje, dodamo, dokler pH ne ne bo nevtralen, pustimo, da se ohladi, na koncu pa voda izhlapi tako, da tvorijo kristali KNO2.
Prijave
Aditiv in reagent
Kalijev nitrit se uporablja kot dodatek za zdravljenje rdečega mesa, ohranjanje njihovega okusa in več časovne barve med shranjevanjem, medtem ko zamuja bakterijsko delovanje in nekatere toksine, kot so botuliniki. Zato ima antibakterijsko delovanje.
Kno2 Okvidira ne, kar reagira z mioglobinom mesa in posledično na koncu spremeni svojo naravno rdečo barvo. Potem, ko je meso kuhano, pridobi svojo značilno močno roza barvo.
Vam lahko služi: 20 primerov kemične sublimacije in značilnostiVendar pod pogoji brez navedbe kno2 reagira z mesnimi beljakovinami, da povzroči nitrozamin, ki lahko postane rakotvoren.
Po drugi strani pa kno2 (čeprav po možnosti nano2) To je analitični reagent, ki ga lahko uporabimo pri sintezi azojskih barvil (reakcija dušikove kisline z aromatičnimi amini) in pri analizi aminokislin.
Protistrup
Medtem ko ima svoje negativne učinke, kno2 Deluje kot protistrup pri zastrupljenih bolnikih s cianidi in vodikovim sulfidom. Njen mehanizem je oksidacija centrov vere2+ do vere3+ od skupin, ki jih imamo od hemoglobinov, ki proizvajajo methemoglobin, ki nato reagira s CN anioni- in hs-.
Zdravniki
V želodčnem soku želodca anion ne2- Zmanjša se na ne, za katerega je znano, da deluje vazodilatator, povečuje pretok krvi. V drugih regijah telesa, kjer pH ni dovolj kisline, so nekateri encimi, kot je oksidortirana ksantina, odgovorni za zmanjšanje ne -2-.
Kno je bil uporabljen2 Za zdravljenje bolezni in bolezni, kot sta angina prsnega koša in epilepsija (z zelo negativnimi stranskimi učinki).
Reference
- Wikipedija. (2019). Kalijev nitrit. Pridobljeno iz: v.Wikipedija.org
- Prebchem. (2016). Priprava kalijevega nitrita. Okreval od: Prepchem.com
- Mark Gilchrist, Angela c. Shore, Nigel Benjamin. (2011). Anorganski nitrat in nitrit ter nadzor krvnega tlaka, srčno-žilne raziskave, letnik 89, številka 3, 15. februar 2011, strani 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Kalijev nitrit. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Kemična formulacija. (2018). Kalijev nitrit. Obnovi se od: quimica formulacije.com
- Nacionalni center za napredovanje translacijskih znanosti. (2011). Kalijev nitrit. Okrevano od: droge.NCATS.Io
- Richard J. ELEY, PAUL B. Addis in Joseph J. Wartheen. (1992). Nitrit v mesu. Univerza v Minnesoti.
- N. R. Rao, b. Prakash in m. Natarajan. (1975). Preoblikovanja kristalne strukture v anorganskih nitrijih, nitratih in karbonatih. Oddelek za kemijo, Indijski tehnološki inštitut, Kanpur, Indija.
- « Politične značilnosti govora, vrste, vprašanja in primeri
- Vzroki, posledice in primeri onesnaževanja smeti »

