Dalton Atomski model

- 1000
- 227
- Dexter Koch
Pojasnjujemo Daltonov atomski model, njegove postulacije in omejitve
 Daltonov atomski model je prvi temeljil na znanstvenih raziskavah. Vir: f. Zapata.
Daltonov atomski model je prvi temeljil na znanstvenih raziskavah. Vir: f. Zapata. Kaj je Daltonov atomski model?
On Dalton Atomski model Predlaga, da vse snovi sestavljajo drobne in nedeljive enote, imenovane atomi, s čimer je ponovno zamislil ideje, ki so jih nekdanji grški misleci oblikovali pred dvema tisoč leti.
To je prvi atomski model, ki je izšel iz skrbnega eksperimentiranja v laboratoriju, saj čeprav je človeštvo vedno poskušalo razumeti, kaj je pomembna, do zgodnjega devetnajstega stoletja so bile možnosti eksperimentalnega preverjanja teorij še vedno omejene.
Vendar pa je na področju instrumenta, razen dobrega opazovalca narave, učitelj angleščine John Dalton (1766-1844) izstopal, ker je ustvaril več merilnih naprav, ki jih bo pozneje v svojem laboratoriju uporabil za preučevanje plini.
Tako je Dalton spoznal, da se snovi združijo po določenih pravilih, in da bi to pojasnil, je postavil, da je bila vsa snov sestavljena iz atomov, drobnih, homogenih sfer in nimajo notranje strukture. Atomi, je dejal, tvorijo spojine po določenih razmerjih, med kemično reakcijo pa se ponovno ločijo in združijo, ustvarjajo nove spojine.
Dalton ni le razvil prvega atomskega modela, ki temelji na strogih eksperimentiranju. Ustvaril je tudi nomenklaturni sistem za elemente, jim ukazal za njihovo atomsko težo, določil zakon o več razmerjih, zakon delnih pritiskov in opisal slepoto do določenih barv, stanje, ki ga je sam trpel, imenovan, imenovan barvna slepota.
Njegovi obsežni prispevki k znanosti so si v svoji znanstveni karieri prislužili številne razlike, toda Dalton je vedno živel skromen in preprost način, posvečen znanosti do konca svojih dni.
Kratka zgodba
Od oddaljenih časov je človeštvo poiskalo razlago o naravi snovi. Grški misleci iz 5. stoletja.C, in preden so nekateri hindujski filozofi postavili, da so zadevo sestavljale osnovne enote, imenovane Atomi. Vendar jim ni manjkalo potrebne eksperimentalne podpore za preverjanje svojih teorij.
Vam lahko služi: kakšne so toplotne lastnosti in kaj so? (S primeri)Prvi atomski model je pripisan Leucipu in njegovemu demokratu učencem Abdere (460. C. - 370 a. C.). Že od prvega malega je znano, toda demokrat je bil modrec velikega priznanega, primerljivega s Platonom in Aristotelom, čeprav je nekaj drobcev njegovega dela komaj ohranjenih.
Demokrit je atom zamislil kot končnega delca, ki tvori zadevo, nedeljivo in neuničljivo. Glede na njihove teorije so bile vse snovi sestavljene iz teh delcev, premajhne, da bi jih videli. In glede na način združevanja so atomi subjektu zagotovili njihove značilne lastnosti.
V nasprotju s tem po komentarju. Aristotelove neprekinjene ideje so končno prevladale do začetka 19. stoletja.
Daltonova dela
Leta 1793 je John Dalton zanimala meteorologija in nadaljevala pri preučevanju atmosferskih plinov in njihovih lastnosti. Zahvaljujoč svojim poskusom je spoznal, da so elementi, kot je kisik, vedno združeni v določenem deležu, ki ga je dalo celo število.
Leta 1803 je Dalton pojasnil, da so ti deleži posledica dejstva, da je zadeva sestavljena iz osnovnih delcev, imenovanih atomi, kot je že zdavnaj dejal demokrat. Predlog je predstavil v delu "Nov sistem kemične filozofije", v katerem je opisal rezultate svojih poskusov.
Poleg tega je v tem delu vključeval tudi posebne simbole, ki predstavljajo posamezne atome vsakega elementa in tako postavijo temelje sodobne kemije.
Vam lahko služi: akutni zvoki: značilnosti in primeriPojasnilo Daltonovega atomskega modela
V času, ko je Dalton razvil svoje delo, so drugi znanstveniki že odkrili nekatere zakone, ki urejajo subjekt, in kombinacije med elementi: Antoine Lavoisier je ugotovil, da se med kemično reakcijo masa ne ustvarja ali uniči, ampak to postane.
Temu zakonu je sledil Proustjev zakon o določenih razmerjih in ugotovil, da ko sta dva elementa združena, to vedno počneta v fiksnih razmerjih.
Zdaj je bil del Daltonovih poskusov sestavljen iz preučevanja absorpcije vode v vodi. Tam je opazil, da lahko določena količina vode absorbira le določeno količino plina in da se je ta količina spreminjala glede na plin. Poleg tega bi bilo mogoče plin obnoviti iz vode, tako da so njene lastnosti nedotaknjene.
Odkril je tudi, da ko lahko dva elementa združimo, da nastane več kot eno spojino, količina vsakega ostanka pritrjena in ohranja preprost numerični odnos, na primer 1: 1, 1: 2; 2: 3 in tako naprej. To je klic Zakon več razsežnosti.
Dalton je razložil ta dejstva, da je plin, voda in na splošno vse materije sestavljen iz osnovnih kosov, ki v kombinaciji povzročajo različne spojine. Vsak element je sestavljen iz značilnih delcev (Dalton jih na začetku ni imenoval atomov), vendar tudi v kombinaciji takšni delci ohranjajo svoje nespremenjene lastnosti.
Daltonov atomski model postulira
Daltonov atomski model je povzet v naslednjih izjavah:
1. Snov sestavljajo drobni nedeljivi delci, imenovani atomi.
2. Vsak element je sestavljen iz enakih atomov med seboj in z enakimi lastnostmi. Atomi elementa se razlikujejo od drugih.
3. Z pridruževanjem dveh ali več atomov različnih elementov to storijo v določenih in preprostih razmerjih in tako ustvarijo spojine, ki jih tvorijo molekule. Molekule določene spojine so enake drug drugemu.
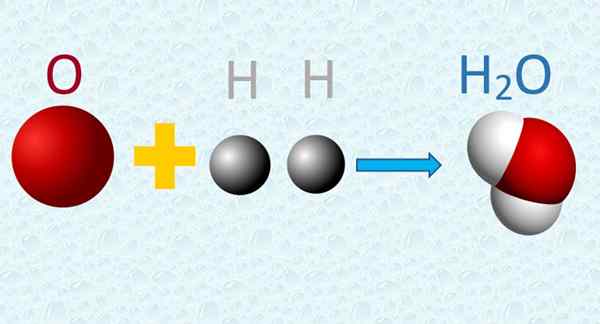 V molekuli vode se kisik in vodikovi atomi kombinirajo v preprostih razmerjih. Vir: f. Zapata.
V molekuli vode se kisik in vodikovi atomi kombinirajo v preprostih razmerjih. Vir: f. Zapata. 4. Med izmenjavo kemičnih reakcij se atomi, vendar ne trpijo nobene preobrazbe, niti v postopku niso ustvarjene ali uničene.
Neuspeh v Daltonu
Znanstvene raziskave so v devetnajstem stoletju doživele izjemen razcvet, ki ga je spodbujala industrijska revolucija. In glavne neuspehe Daltonovega atomskega modela niso bile razkrite:
Vam lahko služi: medfazna napetost: definicija, enačba, enote in meritve1. Atom ni nedeljiv
To je ena najpomembnejših napak Daltonovega atomskega modela. Poskusi, izvedeni v devetnajstem in dvajsetem stoletju, so pokazali, da je atom sestavljen iz množice subatomskih delcev.
Prvi, ki sta se poznala, sta bila elektron in proton, kasneje pa se je naučil o obstoju nevtrona. Nato sta tako proton kot nevtrona razkrila svojo notranjo strukturo.
2. Atomi istega elementa morda niso enaki
Elementi imajo izotope, ki se, čeprav imajo enake kemijske lastnosti, razlikujejo po številu nevtronov, zato je njihova atomska teža drugačna. Na primer, vodikovi izotopi so Protio, Deuterium in Tritium.
3. Atomi niso nesposobni
Obstajajo radioaktivne snovi, ki oddajajo delce in energijo, ki se spreminjajo v druge elemente.
4. Atomi se ne kombinirajo vedno v celotnih razmerjih
Dokazano je, da obstajajo organske, bolj zapletene spojine, ki ne sledijo natančnemu Daltonovemu zakonu o več razmerjih.
Zanimivi članki
Schrödinger Atomski model.
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Leucipo.
Atomski model Bohr.
Atomski model Rutherford.
Trenutni atomski model.

