Značilnosti miofibrilov, struktura, sestava, funkcije
- 2867
- 40
- Miguel Gutmann DVM
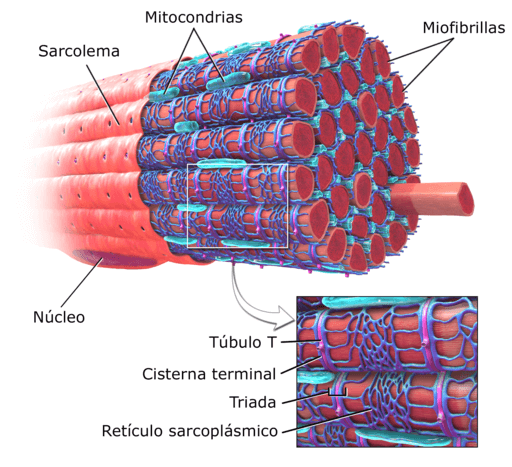
The Miofibrili So strukturne enote mišičnih celic, znane tudi kot mišična vlakna. So zelo obilne, pritrjene so vzporedno in jih vgradi citosol teh celic.
Stražene celice ali vlakna mišičnih vlaken so zelo dolge celice, ki lahko merijo do 15 cm dolge in od 10 do 100 μm premera. Njegova plazemska membrana je znana kot sarkolema in citosol kot sarkoplazma.
 Diagram mišične strukture človeka (vir: deglr6328 ~ commonswiki, prek Wikimedia Commons)
Diagram mišične strukture človeka (vir: deglr6328 ~ commonswiki, prek Wikimedia Commons) Znotraj teh celic so poleg miofibrilov več jeder in mitohondrijev, ki so znani kot sarkosomi, pa tudi vidni endoplazemski retikulum, znan kot sarkoplazemski retikulum.
Miofibrili so prepoznani kot "kontraktilni elementi" mišic pri živalih z vretenčarji. Sestavljeni so iz različnih vrst beljakovin, ki so tiste, ki jim dajejo elastične in izvlečne značilnosti. Poleg tega zasedajo pomemben del sarkoplazme mišičnih vlaken.
[TOC]
Razlike med mišičnimi vlakni
Obstajata dve vrsti mišičnih vlaken: progata in gladka vlakna, vsaka z anatomsko porazdelitvijo in določeno funkcijo. Miofibrili so še posebej pomembni in očitni v progah mišičnih vlaken, ki sestavljajo skeletne mišice.
Stroirana vlakna imajo ponavljajoč vzorec prečnih pasov, ko jih opazimo na mikroskopu in so povezani s skeletnimi mišicami in del srčne muskulature.
Gladka vlakna nasprotno ne predstavljajo istega vzorca pod mikroskopom in jih najdemo v značilnih mišicah vaskulature in prebavnega sistema (in vseh viscera).
Splošne značilnosti
Miofibrili so sestavljeni iz dveh vrst kontraktilnih filamentov (znanih tudi kot miofilamente), ki so sestavljeni iz miozinskih in aktinskih filamentnih beljakovin, ki bodo opisani pozneje.
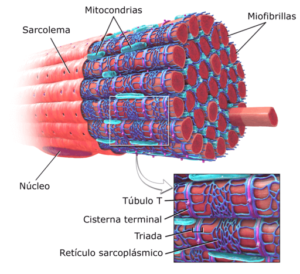 Grafični prikaz miofibrilov v skeletnih mišicah (vir: Modified Brublaus [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons)
Grafični prikaz miofibrilov v skeletnih mišicah (vir: Modified Brublaus [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons) Različni raziskovalci so ugotovili, da povprečna življenjska doba kontraktilnih beljakovin miofibrilov traja od 5 dni do 2 tedna, zato je mišica zelo dinamično tkivo, ne le s kontraktilnega vidika, temveč tudi sinteze in obnove njegovih strukturnih elementov.
Funkcionalna enota vsake miofibrile v mišičnih celicah ali vlaknih se imenuje Sarcocomro in jo omejuje regija, znana kot "bend ali linija Z", od koder se miofilamenti aktina vzporedno razširijo.
Ker miofibrili zasedajo velik del sarkoplazme, te vlaknaste strukture omejujejo lokacijo središč celic, na katere pripadajo obodu, blizu Sarkoleme.
Lahko vam služi: človeška celica: značilnosti, funkcije, deli (organele)Nekatere človeške patologije so povezane s premikom jeder v miofibrilarne žarke in te so znane kot centralno jedrske miopatije.
Oblikovanje miofibrilov ali "miofibrilogeneze"
Prvi miofili so sestavljeni med razvojem embrionalne skeletne mišice.
Beljakovine, ki sestavljajo sarcomerje (funkcionalne enote miofibrilov), so sprva poravnani s koncev in strani "nagrade", ki so sestavljene iz aktinskih filamentov in majhnih delov miozina II nemuskularno in α-specifično specifično dejanje mišic.
Kot se to zgodi, v mišičnih vlaknih izražajo v različnih razmerjih, kodirajočih genov za srčne in skeletne izoforme α-aktina. Najprej je količina srčne izoforme, ki je izražena, večja in potem se to spremeni v skeletno.
Po nastanku nagrade se za območje tvorbe nagrad sestavljajo miofibrili, v teh pa se odkrije oblika mišičnega miozina II.
Na tej točki so miozinski nitki poravnani in zapleteni z drugimi specifičnimi beljakovinami miozinske zveze, ki se pojavljajo tudi z aktinskimi nitkami.
Struktura in sestava
Kot smo že omenili, so miofibrili sestavljeni iz kontraktilnih beljakovinskih miofilamentov: aktin in miozin, ki sta znana tudi kot tanki in debeli miofilamenti. Ti so vidni za optični mikroskop.
- Tanki miofilamenti
Tanke nitke miofibrilov so sestavljene iz aktinskih beljakovin v njegovi nitasti obliki (aktin f), ki je polimer v kroglični obliki (aktin g), ki ima manjšo velikost.
Nitasti prameni aktina g (aktin f) tvorijo dvojni pramen, ki je zavit v obliko propelerja. Vsak monomer teh tehta več ali manj 40 kDa in se lahko pridruži miozinu na določenih krajih.
Te nitke imajo premera približno 7 nm in segajo med dvema območjem, znani kot Band I, in The Band A. V pasu A so te nitke nameščene okoli debelih nitk, ki tvorijo sekundarno šesterokotno razporeditev.
Konkretno je vsaka tanke filamente simetrično ločena od treh debelih nitk, vsaka debela nihala.
Tanke in debele filamente medsebojno medsebojno delujejo skozi "križne mostove", ki izstopajo iz debelih filamentov in se v redni intervali razdalj v bližini 14 nm pojavijo v strukturi miofibrile.
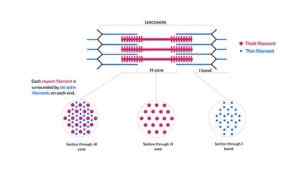 Shematski prikaz miofilamentov, ki sestavljajo miofibrile in njihove navzkrižne reze (vir: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Shematski prikaz miofilamentov, ki sestavljajo miofibrile in njihove navzkrižne reze (vir: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Aktinske filamente in drugi povezani beljakovine segajo, ki štrlijo z "robov" z vrstic in se prekrivajo z miozinskimi nitkami proti središču vsakega sarcomero.
Lahko vam služi: celična prehrana: proces in hranila- Debela miofilamente
Debele filamente so polimeri proteina miozina II (po 510 kDa) in jih omejujejo regije, znane kot "pasovi a".
Miofilamenti miozina so dolgi približno 16 nm in so razporejeni v šesterokotni ureditvi (če opazimo presek miofibrile).
Vsaka miozin II filamente sestavljajo številne pakirane molekule miozina, vsaka pa je sestavljena iz dveh polipeptidnih verig, ki imata regijo ali "glavo" v obliki maze in ki se sprejmejo v "kupci", da oblikujejo filamente.
Oba snopa se vzdržujeta skozi svoje konce v središču vsakega sarcomera, tako da so "glave" vsakega miozina usmerjene proti liniji z.
Miozinske glave izpolnjujejo zelo pomembne funkcije, saj imajo sindikalna mesta za molekule ATP, poleg tega.
- Povezane beljakovine
Aktinske nitke so "zasidrane" ali "popraviti" na plazemsko membrano mišičnih vlaken (Sarcolema), zahvaljujoč interakciji z drugim proteinom, znanim kot distrofin.
Poleg tega obstajata dva pomembna proteina Actin Union, znana kot troponin in tropomiozin, ki skupaj z aktinskimi filamenti tvorita beljakovinski kompleks. Oba beljakovine sta bistveni za uravnavanje interakcij, ki potekajo med tankimi in debelimi filamenti.
Tropomiozin je tudi dvostranska niharna molekula, ki je povezana z Actin Propens posebej v območju žleba, ki se pojavljata med obema pramenom. Troponin je tristranski kroglični beljakovinski kompleks, ki je na voljo v presledkih o aktinskih nitkah.
Ta zadnji kompleks deluje kot "stikalo", odvisno od kalcija, ki uravnava procese krčenja mišičnih vlaken, zato je izjemnega pomena.
V strogi mišici živali z vretenčarji poleg tega obstajata še dva beljakovina, ki medsebojno delujeta z debelimi in tankimi filamenti, znanimi kot titina in nebulina.
Nebulin ima pomembne funkcije pri urejanju dolžine aktinskih nitk, medtem ko titina sodeluje pri podpori in zasidranju miozinskih filamentov v regiji Sarcomero, znanega kot Line M.
Drugi proteini
Obstajajo tudi drugi beljakovine, ki so povezani z debelimi miofilamenti, ki so znani kot beljakovine C miozina in miomezinske zveze, ki so odgovorni za določanje miozinskih nitk v vrstici m.
Lahko vam služi: Unaporto: Prevoz skozi membrane, značilnostiFunkcije
Miofibrili imajo elementarne posledice v zmožnosti premikanja živali z vretenčarji.
Ker jih sestavljajo vlaknasti in kontraktilni beljakovinski kompleksi mišičnega aparata, so to bistvenega.
Nezasmerne dinamične lastnosti skeletnih mišic, ki vključuje več kot 40% telesne teže, podeljujejo miofibrile, ki imajo hkrati 70% beljakovin človeškega telesa med 50 in 70%.
Miofibrili kot del teh mišic sodelujejo pri vseh njihovih funkcijah:
- Mehanika: Pretvoriti kemijsko energijo v mehansko energijo za ustvarjanje trdnosti, vzdrževanje drže, proizvodnjo gibov itd.
- Metabolična: Ker mišica sodeluje v presnovi bazalne energije in služi kot skladiščenje temeljnih snovi, kot so aminokisline in ogljikovi hidrati; Prav tako prispeva k proizvodnji toplote in porabe energije in kisika, ki se uporablja med telesnimi aktivnostmi ali športnimi vajami.
Ker so miofibrili sestavljeni predvsem iz beljakovin, ti predstavljajo mesto za shranjevanje in sproščanje aminokislin, ki prispevajo k vzdrževanju ravni glukoze v krvi med postom ali stradanjem.
Tudi osvoboditev aminokislin iz teh mišičnih struktur ima transcendenco z vidika biosintetskih potreb drugih tkiv, kot so koža, možgani, srce in drugi organi.
Reference
- Despoulos, a., & Silbernagl, s. (2003). Atlas fiziološke barve (5. izd.). New York: Thieme.
- Friedman, a. L., & Goldman in. In. (devetnajst devetdeset šest). Mehanska karakterizacija miofibrilov skeletnih mišic. Biophysical Journal, 71(5), 2774-2785.
- Meja, w. R., & Ochala, J. (2014). Skeletalne mišice: kratek pregled strukture in funkcije. CalcIf tkiva int, Štiri. Pet(2), 183-195.
- Goldspink, g. (1970). Širjenje miofibrilov med rastjo mišičnih vlaken. J. Celični sct., 6, 593-603.
- Murray, r., Bender, d., Botham, k., Kennelly, str., Rodwell, v., & Weil, P. (2009). Harperjeva ilustrirana biokemija (28. izd.). McGraw-Hill Medical.
- Rosen, J. N., & Baylies, m. K. (2017). Miofibrili postavljajo stiskanje na jedra. Naravna celična biologija, 19(10).
- Sanger, j., Wangs, j., Ventilator in., White, J., Mi-my, l., Dube, d.,... Pruyne, D. (2016). Montaža in vzdrževanje miofibrilov v Striadni mišici. V Priročnik eksperimentalne farmakologije (P. 37). New York, ZDA: Springer International Publishing Švica.
- Sanger, j. W., Wang, J., Ventilator in., White, J., & Sanger, J. M. (2010). Montaža in dinamika miofibrilov. Časopis za biomedicino in biotehnologijo, 2010, 8.
- Sobieszek, a., & Bremel, r. (1975). Priprava in lastnosti vretenčarjev gladke - mišične miofibrile in aktomiozin. Evropski časopis za biokemijo, 55(1), 49–60.
- Villee, c., Walker, w., & Smith, F. (1963). Splošna zoologija (2. izd.). London: w. B. Podjetje Saunders.
- « Značilnosti lobelije, habitat, distribucija, vrste
- Značilnosti cefalopodi, habitat, razmnoževanje, prehrana »

