Značilnosti mieloperoksidaze, struktura, funkcije
- 2906
- 120
- Ms. Pablo Lebsack
The mieloperoxidaza Gre za hemoprotein z oksidortirano encimsko aktivnostjo, ki deluje v različnih celicah imunskega sistema v boju proti invaziranju mikroorganizmov in v drugih celičnih procesih.
To lizosomalno peroksidazo najdemo v granulocitih in monocitih sesalcev in vaj v mikrobicid.
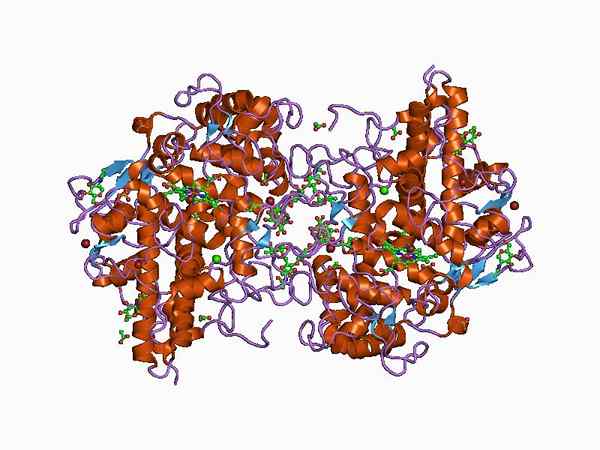
 Predstavitev strukture encima mieloperoksidaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [javna domena] prek Wikimedia Commons)
Predstavitev strukture encima mieloperoksidaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [javna domena] prek Wikimedia Commons) Prvič ga je opisal Agner, ki je skoval začetni izraz "verdoperoxidaze", saj je encim z značilno zeleno barvo.
Nekaj časa pozneje je bilo njegovo ime spremenjeno v mieloperoxidazo, saj je značilen encim celic, ki pripadajo mieloidnim rodom iz kostnega mozga in prisotni v različnih vezivnih tkivih telesa nekaterih živali.
Poleg svojih funkcij v imunskem sistemu za boj proti in Vpadalnemu mikroorganizmih produkti reakcij, ki jih katalizira mieloperoksidaza, povzročijo poškodbe tkiva med različnimi vnetnimi reakcijami.
Njegova aktivnost je bila povezana tudi z razvojem nekaterih srčno -žilnih bolezni in med fazami iniciacije, širjenjem in zapletom aterosklerotičnih procesov, ki se izkoriščajo za diagnozo in terapevtsko posredovanje teh patologij.
[TOC]
Značilnosti
Katalitična funkcija mieloperoksidaze temelji na oksidaciji dveh elektronov Cl-iona, da bi dosegli tvorbo HOCL ali hipoklorozne kisline, ki je pri zaužitju živih organizmov strupena in je lahko celo smrtonosna.
Ta encim je še posebej obilen pri primarnih azurofilnih zrncih v citoplazmi polimorfonuklearnih levkocitov, kjer predstavlja več kot 3% teže teh celic. Najdemo ga tudi v človeških monocitih, ne pa v tkivnih makrofagih.
Lahko vam služi: Woese Classifikacija (3 domenski sistem)Mieloperoxidaza kodira 2 gen.200 osnovnih parov (2.2 kb), ki je odgovoren za sintezo predhodnika peptida 745 aminoazijskih odpadkov.
Pri ljudeh se ta gen nahaja na kromosomu 17, v 12-23 regiji dolge roke in vsebuje 12 eksonov in 11 intronov.
Sinteza tega proteina se pojavlja v promielocitni fazi diferenciacije mieloidnih rodovniških celic in njihove post-translacijske obdelave se pojavi med endoplazemskim retikulu, kompleksom Golgi in plazemskim membranom.
Vključitev hemo protetične skupine se pojavi ne glede na post-translacijsko obdelavo neaktivnega proteina predhodnika.
Struktura
Mieloperoxidaza se sintetizira kot glikoziliran protein predhodnika (z ogljikovimi hidratnimi deli) približno 90 kDa. Ta se pozneje razdeli na dve verigi: ena težka (55-60 kDa) in luč (10-15 kDa).
Zrel protein je sestavljen iz dveh težkih in dveh lahkih verig, ki tvorita 120 do 160 kDa Tetler, z dvema enakima protetičnimi skupinama.
Težka veriga ima 467 aminokislin in je na C-terminalnem koncu beljakovin, lahka veriga pa je sestavljena iz 108 odpadkov.
V polimorfonuklearnih levkocitih so opisane vsaj tri izoforme tega encima, znane kot I, II in III, v HL-60 tumorskih promielocitnih celicah (predhodnikov celic).
Mieloperoxidaze tipa I, II in III polimorfonuklearnega jer. Imajo velik delež v odpadkih v Aspartatu, glutamatu, levcinu in prolinu, pa tudi aminoazúcar N-acetilglukozaminu v porciji Sacararida.
Vam lahko služi: beta oksidacija maščobnih kislin: koraki, reakcije, produkti, regulacijaProtetična skupina teh encimov vsebuje atome železa in vsebnost te kovine se razlikuje glede na živalsko vrsto, ki jo preučujemo. Menijo, da je ta skupina kovalentno povezana s težkimi podenotami strukture, kar je pomembno za encimsko aktivnost.
Funkcije
Mieloperoxidaza je del tistega, kar je znano "sistem mieloperoksidaze", in deluje med fagocitozo in Vrazijočih mikroorganizmov, ki jih spremljajo različne oksidativne reakcije, ki so del fagocitnih vakuol.
Ta sistem mieloperoksidaze je vključen v izločanje bakterij, virusov, zajedav in gliv.
Sistemske komponente so encim mieloperoksidaze, vodikov peroksid in oksidacijski faktor, kot je haluro. Vodikov peroksid se nastaja med dihanjem prek anionov posrednikov Superxides.
Ta peroksid lahko reagira z mieloperoksidazo, da tvori tisto, kar je znano kot spojina I, ki lahko "napade" različne halurose. Ko spojina reagira z drugimi molekulami darovalca elektronov, postane spojina II, vendar to ne more reagirati s halurosom.
Halurosi, ki jih uporabljam, so lahko kloridi, bromidi, jodidi in psevdo haluro tiocianato; Najpogostejši za te encime, v skladu s poskusi In vivo, So kloridi, ki se, ko jih obdela mieloperoksidaza, pretvorijo v hipoklorozno kislino in druge derivate, ki so močne "malicidne" molekule.
Druge reakcije, ki jih katalizira isti encim, proizvajajo proste hidroksilne radikale, "singletne" kisikove atome, ki niso nič drugega kot atomi kisika v stanju navdušenega in ozona (O3), vsi z baktericidnimi aktivnostmi.
Lahko vam služi: lia agar (železni lizin): kaj je, temelj, priprava, uporabaPri razvoju bolezni
Encim mieloperoksidaze je vključen v promocijo in širjenje ateroskleroze, saj ojača oksidativni potencial vodikovega peroksida, tako da ustvari močne oksidante, ki lahko vplivajo na različne fenolne spojine.
Te reaktivne vrste so vključene v pojav tkivnih lezij, ki se pojavijo med različnimi vnetnimi stanji.
Povečanje sistemskih ravni tega encima se uporablja kot diagnostični označevalec obstoja koronarnih srčnih bolezni in drugih pomembnih srčnih stanj.
Poleg njihovega odnosa z nekaterimi srčnimi boleznimi se napake v mieloperoksidazi prenašajo tudi v imunske patološke razmere, saj lahko okvare v njihovi baktericidni aktivnosti povzročijo nevarne in akutne sistemske okužbe.
Reference
- Kimura, s., & Ikeda-saito, m. (1988). Človeški mieloperoksidae in tiroidna peroksidaza, dva encima z ločenimi in različnimi fiziološkimi funkcijami, sta evolucijsko povezana člana iste genske genske družine. Beljakovine: struktura, funkcija in bioinformatika, 3, 113-120.
- Klebanoff, s. J. (1999). Mieloperoxidae. Protimikrobni sistemi fagocitov, 111(5), 383–389.
- Klebanoff, s. J. (2005). Mieloperoxidae: prijatelj in sovražnik. Journal of Leukocite Biology, 77, 598-625.
- Koeffler, str., Ranyard, J., & Pertcheck, m. (1985). Mieloperoxidae: njegova struktura in izražanje med mieloidno diferenciacijo. Kri, 65(2), 484–491.
- Nicholls, s. J., Hazen, s. L., Nicholls, s. J., & Hazen, s. L. (2005). Mieloperoxidae in srčno -žilne bolezni. Arterioskleroza, tromboza in vaskularna biologija, 25, 1102-1111.
- Tobler, a., & Koefter, h. Str. (1991). Mieloperoxidae: lokalizacija, struktura in funkcija. V Biokemija krvnih celic (str. 255-288). New York: Plenum Press.

