Alkalne kovine Fizikalne in kemijske lastnosti, uporabe, pridobivanje
- 4870
- 1050
- Cary Goyette
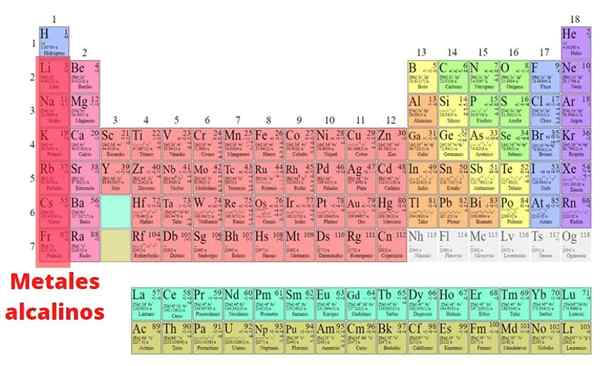
The Alkalne kovine To so elementi, ki so del skupine I periodične tabele, razen vodika: litij (li), natrij (NA), kalij (k), rubidid. Za razliko od večine kovin imajo nizko gostoto in so zelo reaktivne. Zaradi te velike kemične reaktivnosti jih v naravi nikoli ne najdemo v svoji osnovni obliki.
Te kovine tvorijo preproste in stabilne ionske spojine, ki so večinoma topne v vodi; Alkalne kovine običajno kombinirajo ioni halogenida, sulfata, karbonata in silikata. Vendar nekateri elementi tvorijo omejeno število kompleksnih in organometalnih spojin.

Na splošno so bile fizikalne in kemijske lastnosti alkalnih kovin dobro preučene, razen Francia zaradi svoje radioaktivne narave.
[TOC]
Fizične lastnosti
- Alkalne kovine so srebrne, razen cezija, ki je zlati. Izvajajo elektriko in toploto ter imajo nizke tališče, ki se tudi zmanjšajo s povečanjem atomskega števila, ker je povezava med atomi oslabljena s povečanjem atomskega polmera.
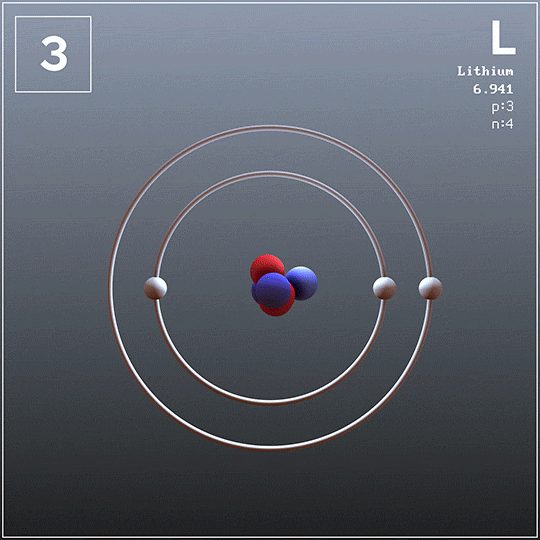
- Dejstvo, da ima samo en elektron Valencije z Atomom. Posledično so tudi alkalne kovine dovolj mehke, da jih režejo z nožem ali lopatico.
- Vsi elementi sprejmejo kubično strukturo, osredotočeno na telo. Ker ta vrsta kristalne strukture ni pakirana in so atomski radijski sprejemniki alkalnih kovin veliki, imajo nizko gostoto v primerjavi z drugimi kovinami. Pravzaprav litij, natrij in kalijev plavajo v vodi.
- Energetske razlike med orbitali plasti Valencije alkalnih kovin sovpadajo z valovnimi dolžinami vidne svetlobe. Zaradi tega se pri segrevanju spojin, ki jih tvorijo te kovine v plamenu, ustvarijo značilne barve.
Lahko vam služi: Trinitrotolueno (TNT): struktura, lastnosti, uporabe, tveganja, eksplozija- V padajočem vrstnem redu litijeve soli dajejo grimizno barvo, natrijeve soli rumene barve, kalijeve vijolične barve, rubidij modrikaste rdeče barve in prenehajo modro barvo.
Kemične lastnosti
Vse alkalne kovine imajo podobnosti v svojih kemijskih lastnostih.
- Imajo elektronsko konfiguracijo Valencia NS1, ki se prenaša v stanje oksidacije +1. To pomeni, da zlahka izgubijo elektron, da dosežejo plemenito konfiguracijo plina.
- Na splošno imajo alkalne kovine najnižje ionizacijske energije vseh elementov, ki se tudi zmanjšajo, ko se atomski polmer v skupini povečuje, ker je plast Valencije vse bolj oddaljena od jedra. To pojasnjuje reaktivnost alkalnih kovin in tvorbo M+ ionov v lahkotnih vodnih pogojih.
- Termodinamična nagnjenost k oblikovanju M+ ionov potrjujejo standardni potenciali parov M+/M, ki so vsi veliki in negativni. Takšen trend pomeni, da alkalne kovine zlahka oksidirajo in lahko delujejo kot močna redukcijska sredstva.
- Ti elementi morajo biti shranjeni v nereaktivnem olju, da se izognemo reakciji z atmosferskim kisikom. Čeprav lahko litij, natrij in kalij kratek čas manipuliramo v zraku, je treba rubidij in cezij ves čas ravnati pod inertno atmosfero.
Pridobivanje alkalnih kovin
Natrij

Najboljši način za pridobitev kovinskega natrija vključuje elektrolizo staljenega natrijevega klorida. Ker je tališče natrijevega klorida precej visoko (808 ° C) in je potrebno veliko energije za vzdrževanje velikih količin staljene snovi, se običajno doda kalcijev klorid (Cacl2), da se talilna točka zmanjša na približno 600 ° C.
Vam lahko služi: turbidimetrijaNatrij dobimo v tekočem stanju v katodi s čistostjo 99,95% pod inertno atmosfero.
Litij in kalij
Litij lahko dobimo tudi iz njegovih kloridov z elektrolizo, vendar ne gre za kalij, ker je preveč topen v kloridu (KCL) in ne plava na površini celice. Poleg tega zlahka izhlapi delovno temperaturo, zato ustvarja nevarne pogoje.
Zato kalij dobimo z redukcijo staljenega KCL s tekočim natrijem. Natrij, ki je prisoten v kaliju, izločimo s kondenzacijo pare pri 892 ° C in izvajanju delne destilacije tekočih kovin.
Rubidio in Cesio
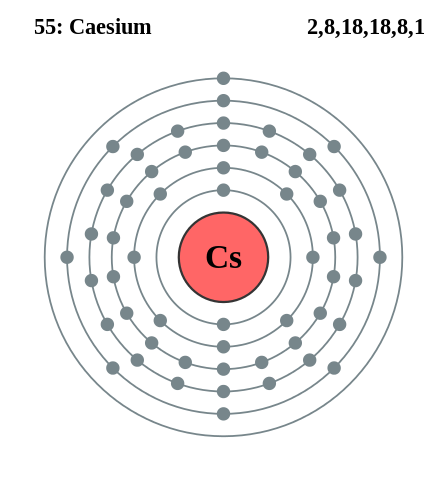 Elektronska konfiguracija cezija. Vir: Pumbaa (izvirno delo Grega Robsona) / CC BY-SA 2.0 UK (https: // creativeCommons.Org/licence/by-sa/2.0/UK/Deed.v)
Elektronska konfiguracija cezija. Vir: Pumbaa (izvirno delo Grega Robsona) / CC BY-SA 2.0 UK (https: // creativeCommons.Org/licence/by-sa/2.0/UK/Deed.v) Rubidio in cezij je mogoče dobiti podobno, vendar z uporabo kalcija kot reducirajočega sredstva. Kovinski cesij lahko dobimo tudi z elektrolizo staljenega cezijevega cianida (CSCN).
Glavna uporaba in aplikacije
Natrij kot reducirajoče sredstvo
Ker je natrij zelo enostavno oksidiran, je njegova najpomembnejša uporaba kot reducirajoče sredstvo za pridobivanje kovin, kot so Titanium, Surround in Hafnio. Uporablja se tudi kot toplotni izmenjevalec v jedrskih reaktorjih v tekočem stanju.
Kalij kot gnojilo
 Kalijev klorid, gnojilo. Vir: Abbas cucaniensis/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0
Kalijev klorid, gnojilo. Vir: Abbas cucaniensis/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0 Večina predelanega kalija gre v gnojila v obliki kalijevega klorida. Klorid se uporablja pri proizvodnji drugih spojin in raztopin, kot je kalijev hidroksid, ki se uporablja pri proizvodnji tekočih mil.
Kalijev cianid se uporablja za ekstrakcijo ali prevleko za kovine za olajšanje odlaganja bakra, srebra in zlata. Kalij najdete tudi v nekaterih eksplozivih in kot ognjemetno barvanje.
Vam lahko služi: radio: struktura, lastnosti, uporabe, pridobivanjeLitij kot sredstva za zlitino
Kovinski litij se uporablja kot sredstvo za zlitino pri proizvodnji aluminijevih in magnezijevih letalskih zlitin in vesoljskih zlitin. Toda s časom se je zdelo naraščajočo uporabnost kot anoda alkalne akumulatorja.
Kovinski litij omogoča tudi zmanjšanje temperature taljenja in sintranja nekaterih vrst stekla in keramike, poleg tega pa zmanjšuje svoj koeficient širitve. Litijev karbonat se pogosto uporablja za zdravljenje bipolarnih razmer, medtem ko je litijev stearat mazivo, ki se pogosto uporablja v avtomobilski industriji.
Rubidio in Cesio
Rubidio in cezij se običajno uporabljata v istih aplikacijah, zato lahko enega od teh elementov nadomestimo z drugim. Aplikacije vključujejo optično steklo v telekomunikacijski industriji, opremo za nočni vid in fotoelektrične celice. Ura Cesio (atomska ura) se uporablja za mednarodni standardni časovni ukrep in za definicijo drugega.
Reference
- Chang, R., & Goldsby, k. Do. (2016). Kemija (12. izd.). New York: MC-Graw Hill.
- Halka, m., & Nordstrom, b. (2010). Alkalne in alkalne zemeljske kovine. New York: Infobase Publishing.
- Miesler, g. L., Fischer, str. J., & Tarr, D. Do. (2014). Anorganska kemija (5. izd.). New York: Pearson.
- Mishra, b., & Majumdar, g. (2017). Proizvodnja alkalijskih kovin (Li, NA, K). Referenčni modul v inženiringu materialov in materialov. Elsevier.
- Petrucci, r. H., Sled, f. G., Bissonnette, c., & Zrelo, j. D. (2017). Splošna kemija: načela in sodobne aplikacije (11. izd.). New York: Pearson.
- Shriver, d., Weller, m., Overton, t., Rourke, J., & Armstrong, f. (2014). Anorganska kemija (6. izd.). New York: W. H. Freeman.
- « V kateri celini je večja koncentracija prebivalstva?
- Značilnosti bronaste dobe, obdobja, orodja in izumi »

