Ritchter-Wenzel Law Kaj je, zgodbe, izjave, primeri
- 3990
- 19
- Don Nitzsche
The Zakon Ritchter-Wenzel ali o vzajemnih razmerjih je tisti, ki določa, da množični deleži med dvema spojinama omogočajo določitev kot tretje spojine. To je eden od zakonov stoihiometrije, skupaj z zakonom Lavoisier (zakon ohranjanja mase); Proust zakon (zakon določenih razsežnosti); in Daltonov zakon (zakon o več razmerjih).
Ritcher je svoj zakon izkazal leta 1792 v knjigi, ki je opredelila temelje Stochiometrije, ki temelji na raziskovalnem delu Carl F Wenzela, ki je leta 1777 objavil prvo tabelo enakovrednosti za kisline in baze.
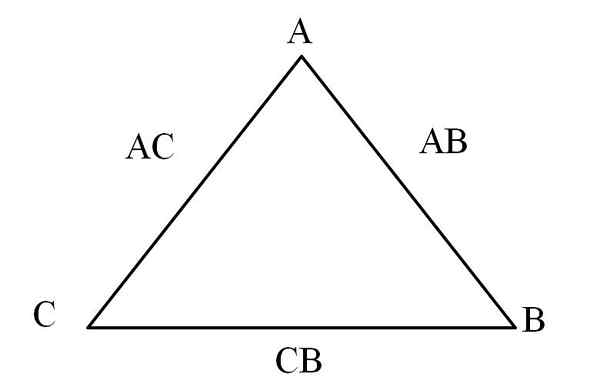
 Trikotnik vzajemnosti. Vir: Gabriel Bolívar
Trikotnik vzajemnosti. Vir: Gabriel Bolívar Preprost način za vizualizacijo je skozi "trikotnik vzajemnosti" (Superior Slika). Če so znane mase A, C in B, ki so mešane tako, da tvorijo spojine AC in AB, je mogoče določiti, koliko C in B mešata ali reagiramo, da tvorita CB spojino.
V spojinah AC in AB je element A prisoten v obeh, zato je pri delitvi njihovih masnih razsežnosti, koliko C reagira z B.
[TOC]
Zgodovina in splošnosti zakona o vzajemnih razmerjih
Richter je ugotovil, da je delež teže spojin, porabljenih v kemični reakciji.
V zvezi s tem je Ritcher ugotovil, da je 615 delov potrebno s težo magnezije (MgO), na primer, da nevtralizira 1000 delov s težo žveplove kisline.
Med letoma 1792 in 1794 je Ritcher objavil povzetek treh zvezkov, ki so vsebovali njegovo delo o zakonu o določenih razmerjih. Povzetek je poskusil s stehiometrijo in jo opredelil kot umetnost kemičnih meritev.
Vam lahko služi: kromatografija fine plasti: značilnosti, za kaj jePoleg tega kaže, da stohiometrija obravnava zakone, po katerih se pridruži snovi, da oblikujejo spojine. Vendar so Richterjeva raziskovalna dela kritizirana zaradi matematičnega zdravljenja, ki ga je uporabil, pri čemer je poudaril, da je prilagodil svoje rezultate.
Leta 1802 je Ernst Gottfried Fischer objavil prvo tabelo kemičnih ekvivalentov, ki je uporabljala žveplovo kislino s sliko 1000; Podobno kot vrednost, ki jo je našel Richter, za nevtralizacijo žveplove kisline z magnezijo.
Vendar je bilo poudarjeno, da je Richter zgradil tabelo kombiniranih pesosov, ki kažejo na delež, v katerem so reagirale številne spojine. Na primer, navaja se, da 859 delov NaOH nevtralizira 712 delov HNO3.
Izjave in posledice
Izjava o zakonu Richter-Wenzel je naslednja: množica dveh različnih elementov, ki sta združeni z enako količino tretjega elementa, ohranjajo enako razmerje kot masa teh elementov, če so med seboj v kombinaciji.
Ta zakon je omogočil vzpostavitev enakovredne teže ali shranjenja teže, na primer količina elementa ali spojine, ki bo reagirala s fiksno količino referenčne snovi.
Richter je imenovan kot kombinirane uteži, povezane z utežmi elementov, ki so bili združeni z vsakim gramom vodika. Richterjeve relativne kombinirane teže ustrezajo tistemu, ki je trenutno znano kot enakovredna teža elementov ali spojin.
V skladu s prejšnjim pristopom lahko zakon Richter-Wenzel navedemo na naslednji način:
Kombinirane teže različnih elementov, ki so kombinirane z določeno težo določenega elementa, so relativne kombinirane uteži teh elementov, če so med seboj kombinirani.
Lahko vam služi: metode ločevanja heterogenih mešanicPrimeri
Kalcijev klorid
V kalcijevem oksidu (CAO) je 40 g kalcija v kombinaciji s 16 g kisika (O). Medtem v hipokloroznem oksidu (Cl2O), 71 g klora je kombinirano s 16 g kisika. Kakšna spojina bi oblikovala kalcij, če bi bila kombinirana s klorom?
Z uporabo trikotnika vzajemnosti je kisik skupni element za obe spojini. Najprej so določeni masni deleži obeh oksigeniranih spojin:
40G CA/16 GO = 5G CA/2G oz
71G Cl/16G oz
In zdaj delita dva masa deleža CAO in CL2Ali pa bomo imeli:
(5G CA/2G O)/(71G Cl/16G O) = 80G CA/142G Cl = 40G CA/71G Cl
Upoštevajte, da je zakon o množičnih razmerjih izpolnjen: 40 g kalcija reagira s 71 g klora.
Žveplovi oksidi
Kisik in žveplo reagiramo z bakrom, da dajeta baker (cuO) oziroma bakreni sulfid (CUS). Koliko žvepla bi reagiralo s kisikom?
V bakrenem oksidu je 63,5 g bakra v kombinaciji s 16 g kisika. V bakrenem sulfidu se 63,5 g bakra pridruži pri 32 g žvepla. Delitev množičnih razsežnosti, ki jih imamo:
(63,5G Cu/16G O)/(63,5G Cu/32G S) = 2032G S/1016G O = 2G S/1G ali
Masni delež 2: 1 je večkratnik 4 (63,5/16), kar kaže, da je Richterjev zakon izpolnjen. S tem deležem dobimo SO, žveplov monoksid (32 g žveplovega reakcije s 16 g kisika).
Če je ta delež razdeljen z dvema, bo 1: 1. Spet je zdaj 4 ali 2, zato je tako2, Žveplov dioksid (32 g žvepla reagira s 32 g kisika).
Vam lahko služi: fucoza: značilnosti, struktura, funkcijeSulfid in železov oksid
Reagiran je železni sulfid (FES), v katerem je 32 g žvepla kombinirano s 56 g železa. Ta element služi kot referenca.
V FES in grdih reakcijskih spojinah, žveplo (S) in kisik (O) v zvezi z železom (vero), najdemo v deležu 2: 1. V žveplovem oksidu (SO) 32 g žvepla se kombinirajo s 16 g kisika, zato je žveplo in kisik v razmerju 2: 1.
To kaže, da je zakon o vzajemnih razmerjih ali zakonu Richterja izpolnjen.
Na primer, za izračun, koliko kisika reagira s 15 g žvepla, lahko uporabimo delež med žveplom in kisikom v žveplovem oksidu (2: 1).
o kisik g = (15 g S) ∙ (1 g O/2g S) = 7,5 g
Reference
- Zakon vzajemnega deleža: Opredelitev in primer. Študij. Okrevano od: študij.com
- Zakon vzajemnih razsežnosti. Kemija librettexts. Okrevano od: kem.Librettexts.org

