Henryjev zakon

- 3664
- 153
- Mr. Shane Larkin
 Henryjev zakon pojasnjuje šumenje brezalkoholnih pijač
Henryjev zakon pojasnjuje šumenje brezalkoholnih pijač Kaj je Henryjev zakon?
The Henryjev zakon Razmerje opisuje učinek pritiska na topnost plina. Ta zakon določa, da je topnost plina v stiku s površino tekočine pri določeni temperaturi neposredno sorazmerna z delnim tlakom omenjenega plina na tekočini.
To pomeni, da večji kot je tlak plina na tekočino, večja je skupna količina plina, ki se lahko v njem raztopi, s čimer dobimo večjo koncentracijo (to je večja topnost).
Henryjev zakon, ki ga vidimo v akciji vsakič, ko odkrijemo pijačo sode. Ker je zaprt, visok tlak v steklenici ohranja ogljikov plin. Toda z razkritjem se tlak plina zmanjšuje, kar zmanjšuje njeno topnost in pobegne, ki tvorijo mehurčke in šumenje.
Henryjeva zakonska formula
V matematični obliki je Henryjev zakon izražen kot zakon sorazmernosti:
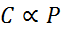
Ta zakon o sorazmernosti se spremeni v:
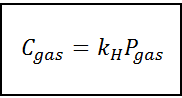
Kje C Nanaša se na največjo koncentracijo plina v tekočini, to je njena topnost; Strplin Je delni tlak plina v stiku s tekočino in kH To je konstanta sorazmernosti Henryjev zakon konstanten.
Koncentracija plina se lahko izrazi v različnih enotah, kot so molarnost, mole ali molarna frakcija. Vendar v večini primerov kemikalije uporabljajo koncentracijo v enotah molarnosti (v mol/L), medtem ko je tlak izražen v atmosferi.
Vam lahko služi: antracen: kaj je, struktura, lastnosti, uporabeStalnica Henryjevega zakona (kH)
Stalnica kH Opišite interakcije med plinom in topilom. Močnejše kot so te interakcije, večja je konstantna in zato večja je topnost plina v topilu pri določeni temperaturi in tlaku.
Številčno, vrednost kH predstavlja topnost plina pri dani temperaturi, ko je delni tlak istega 1 atm.
Odvisno od enot koncentracije in tlaka, uporabljene v enačbi, ima lahko ta konstanta enote mol/L.bankomat, mol/kg.bankomat itd.
Naslednja tabela prikazuje vrednosti konstante Henryjevega zakona za nekatere skupne pline v vodi pri 25 ° C:

Te vrednosti se s temperaturo zmanjšujejo, saj se topnost plinov na splošno zmanjša pri višji temperaturi.
Pojasnilo Henryjevega zakona
Henryjev zakon je z mikroskopskega vidika zelo enostavno razumeti. Lahko si predstavljamo plin kot niz zelo majhnih delcev, ki odskočijo na vseh površinah, ki igrajo. Ko trčijo na površino tekočine, bodo nekateri delci odskočili, drugi pa bodo prečkali površino, ki se ujame (torej se bodo raztopili).
Enako velja za delce plinov, ki se raztopijo. Odskočijo se s stenami posode in lahko dosežejo tudi površino tekočine, kjer bodo nekateri odskočili, drugi pa prečkali površino in pobegnili v plinsko fazo.
Ko je ravnovesje doseženo, so hitrosti, s katerimi se plin raztopi v topilu in s katerim pobegne.
Vam lahko služi: mehanske lastnosti kovin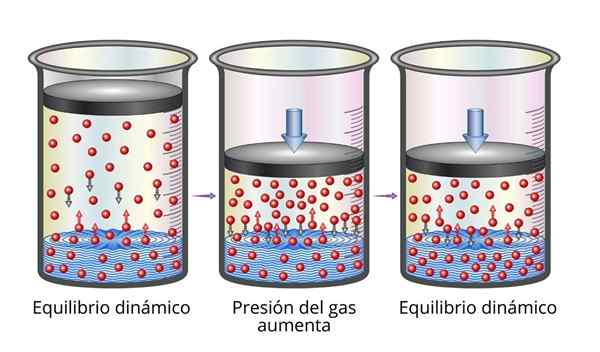 Pojasnilo Henryjevega zakona
Pojasnilo Henryjevega zakona Ko povečamo tlak plina, je tisto, kar počnemo, povečati frekvenco, s katero se delci plinov trčijo na površino tekočine. Zaradi tega se hitrost, s katero se raztopi plin, poveča. Ko bo doseženo novo ravnovesje, bo nova koncentracija plina večja.
Izjeme od Henryjevega zakona
Pomembno je poudariti, da je Henryjev zakon idealen zakon, ki opisuje vedenje resničnih plinskih rešitev pod določenimi pogoji. Tako je Henryjev zakon mogoče uporabiti le, ko:
- Temperatura ostane konstantna.
- Plin je v ravnovesju z raztopino.
- Tlak plina je razmeroma nizek.
- Plin ne reagira s topilom.
Kljub temu lahko tudi v nekaterih primerih, ko plin reagira s topilom, ta zakon uporabimo približno.
Primeri uporabe Henryjevega zakona
Primer 1: Določitev konstante Henryjevega zakona
Eksperimentalno je bilo ugotovljeno, da je koncentracija vodne raztopine v ravnovesju z neonom pri tlaku 3,00 atm in 25 ° C 0,00135 mol/L. Določite konstanto Henryjevega zakona o neonu v vodi pri 25 ° C.
Rešitev:
Po Henryjevem zakonu:
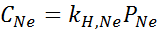
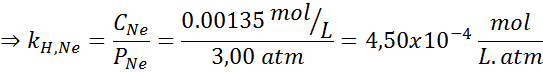
Zato je Henryjev zakon konstanta za neone v vodi pri 25 ° C 4,50 × 10-4 mol/l.Bankomat.
Primer 2: Določitev topnosti plina
Z uporabo konstante Henryjevega zakona, navedene v prejšnji tabeli, določite topnost ogljikovega dioksida zraka v vodi na morskem nivoju, vedoč, da je molarni delež omenjenega plina v zraku 3,14 × 10-4.
Rešitev:
Na morskem nivoju je zračni tlak 1 atm, delni tlak CO2 Daje ga:
Lahko vam služi: hipotedozna kislina (HIO)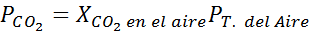
Nadomeščanje tega izraza v Henryjevem zakonu:
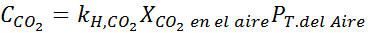
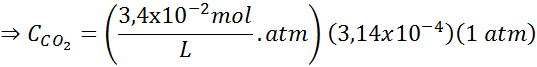
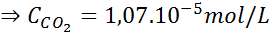
Primer 3: potapljaški plini
Ko potapljač nič na globinah, večjih od 30 metrov, mora mešanica zraka dihati z drugimi inertnimi plini, kot sta helij ali argon težave.
Ta učinek začne opazovati pri dihanju zraka (xN2= 0,78) pri tlaku 4,00 atm. Če se potapljač namerava spustiti do 100 metrov globoko, kjer je pritisk okoli 11,0 atm, kakšen je največji frakcija dušika, ki lahko diha pred trgovcem z mamili?
Rešitev:
Na podlagi izjave lahko sklepamo, da je največja koncentracija dušika tisto, kar se zgodi, ko je zračni tlak 4,00 atm. Po Henryjevem zakonu in uporabi razmerja med popolnim pritiskom in delnim pritiskom prejšnjega primera:
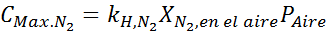
To mora biti enaka največja koncentracija pri vsakem skupnem tlaku. Torej, 100 metrov:
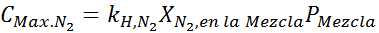
Če izenačimo obe enačbi, lahko v mešanici najdemo največjo molsko frakcijo dušika:
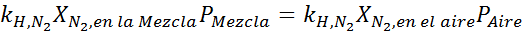
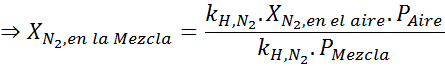
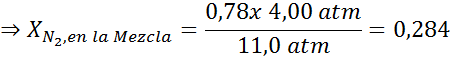
To pomeni, da potapljač ne bi smel uporabljati mešanice, ki vsebuje več kot 28,4% dušika, če namerava potopiti do 100 metrov globoko.

