Koncept, tipi, primeri adsorpcijske izoterme

- 1692
- 86
- Mr. Shane Larkin
The Adsorpcijske izoterme So grafični reprezentaciji obnašanja adsorbiranega delca na površini trdne ali tekočine, ko se njegova koncentracija poveča. Če adsorbirani delci ustrezajo plinom, se upošteva njegov tlak.
Z opazovanjem te izoterme je mogoče sprejeti idejo o tem, kako poteka postopek adsorpcije; In torej, kako so interakcije med delci in površino in površinske značilnosti. Analiza izoterme se sklepa, če je površina gladka, porozna ali mikroporozna, pa tudi možne kondenzacije.
 Komponente, potrebne za graf ali konstrukcijo adsorpcijskih izoterm. Vir: Gabriel Bolívar.
Komponente, potrebne za graf ali konstrukcijo adsorpcijskih izoterm. Vir: Gabriel Bolívar. Vrhunska slika pomaga razjasniti prej omenjene. Adsorbirani delci (vijolični krogi) so tako imenovani adsorbati. Medtem ko je adsorbent tisti, ki ima območje, na katerem bodo adsorbate adsorbirani. Ko se vaš tlak ali koncentracija povečuje, večji adsorbirani volumen nad adsorbentom.
Ta preprosta predstavitev ustreza adsorpciji, ki jo opisuje izoterma tipa I. Uporaba izoterme, adsorptions plinov ali tekoče neskončnosti na gelih, trdnih snovi ali katalizatorjih.
[TOC]
Vrste adsorpcijskih izoterme
 Adsorpcijske izoterme za plin-trdne sisteme. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0
Adsorpcijske izoterme za plin-trdne sisteme. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0 Pet glavnih eksperimentalnih izoterme, ki jih uporablja S. Brunauer za razvrščanje plinastih delcev na trdnih snovi. Vsak opisuje drugačen postopek adsorpcije. Vsak ima tudi matematične modele, ki si prizadevajo za vedenje svojih krivulj.
Os X ni na voljo, kakšne so enote ali spremenljivke, ki se uporabljajo v osi x (p/PO) in y (x), osi X kaže, koliko tlaka ali pretvorbe adsorbata "deluje" na trdni snovi; Medtem ko je os Y, pove, koliko tega je bilo res adsorbirano na površini omenjene trdne ali adsorbenta.
Lahko vam služi: bakreni sulfat (CuSO4): struktura, lastnosti, pridobivanje, uporabeKo se premikamo na desno od osi x, vidimo, kako se količina adsorbiranih delcev poveča, odvisno od povečanja njihovih pritiskov ali koncentracij. To vodi do največjega, razpada, doline itd., To nekako ali drugače omogoča razlago, kako poteka adsorpcija.
Tipa I izoterma
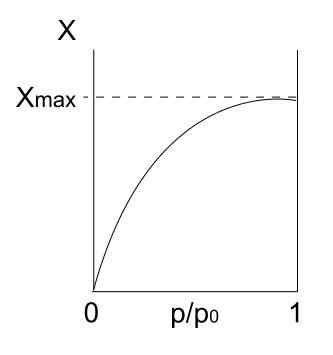 Tipa I izoterma. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0
Tipa I izoterma. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0 Zgoraj imamo izotermo tipa I, ki je znana tudi kot Langmuir izoterma, saj je njegov model napovedoval obliko te krivulje. Če ga vidimo, se takoj razlaga, da obstaja največja količina (xmax) adsorbiranih delcev, ki se ne bodo razlikovali, ne glede na to, koliko pritiski se povečajo.
Ta največja adsorpcijska vrednost je lahko posledica več razlogov. Eden od njih je, da se dogaja kemisorstvo, kar pomeni, da so delci ali adsorbati močno vezani na površino trdne snovi ali adsorbenta. Ko na površini ni več prostora za namestitev več delcev, ne bo več adsorpcije.
Nato se reče, da se je oblikoval enoplast (na primer vijolični krogi prve slike).
Drugi razlog za utemeljitev izoterme tipa I je, da se pojavi fizisorpcija, kar pomeni, da so interakcije med delci in površino zelo šibke (ne pomenijo tvorbe kemičnih vezi).
V tem primeru delci na koncu vstopijo v Microporos, ki se enkrat napolni, površina ne bo imela več mest za naslednje adsorkcije; To pomeni, da ima na voljo malo zunanjega območja (kot da bi bila zelo dobra rešetka). To vedenje opazimo, ko analiziramo mikroporozni praški.
Vam lahko služi: silicij: zgodovina, lastnosti, struktura, pridobivanje, uporabeTip izoterme Ii
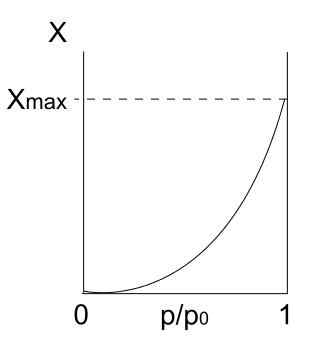
 Izoterma tipa II. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0
Izoterma tipa II. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0 Up imamo izotermo tipa II, znan tudi kot sigmoidna izoterma. To opisuje fizične procese tako za neporozne trdne snovi kot makroporozne trdne snovi.
Upoštevajte, da na začetku spominja na prejšnjo izotermo, kar pomeni, da adsorbirani delci tvorijo enoplast na adsorbentni površini. Ko je enoplast pripravljen, bodo ostali delci adsorbirani nad prvim, kar bo povzročilo večplastne. To je takrat, ko vidimo značilno povečanje te izoterme (desno).
Drugi razlog, zakaj se pridobi izoterma tipa II, je zato, ker delci čutijo večjo afiniteto do površine. To pomeni, da bo enoplast (delci-superficie) pozneje bolj stabilen in trajen kot večplastni (delci).
Tip izoterme Iii
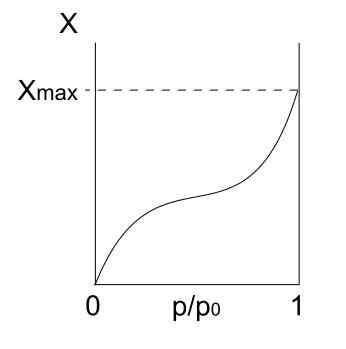
 Izoterm tipa III. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0
Izoterm tipa III. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0 Izoterma tipa III je v zvezi z njegovo razlago podobna tipu II: Multicapas in Physis. Vendar so tokrat interakcije med multicaPA močnejše od interakcij enoplasti s površino trdne snovi. Zato gre za nepravilno adsorpcijo z naboji adsorbiranih delcev in prostimi površinskimi deli.
Tip izoterme Iv
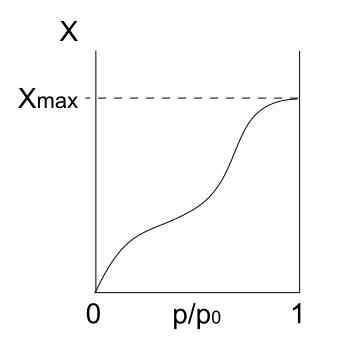 Izoterm tipa IV. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0
Izoterm tipa IV. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0 Izoterm tipa IV opisuje tudi fizisorpcijske in večplastne procese, ki so videti kot izoterma tipa II; Toda zdaj, v poroznih (in mezoporoznih) trdnih snovi, kjer je kondenzacija plinastih delcev mogoča v majhnih količinah tekočine. Dokler pore s tekočino ni "pokrita", enoplast ne bo končan.
Vam lahko služi: Kemija hrane: študijsko področje, elementi, aplikacijeTip izoterme V
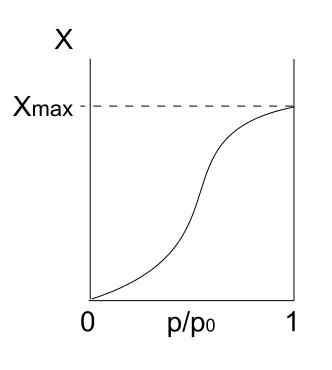 Tipa V izoterm. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0
Tipa V izoterm. Vir: Daniele Pugliesi/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0 Izoterma tipa V je podobna tipu IV, le tokrat so tvorbe multicaps bolj nagnjene kot ustrezni mono forpa. To pomeni, da spominja na adsorpcijo, ki jo opisuje izoterma tipa III. Tukaj Multicapa doseže največjo debelino, kjer ni krajev za več delcev za adsorbiranje.
Primeri
Nekaj primerov plinsko trdnih sistemov bo omenjeno spodaj poleg vrste izoterme, ki so bile pridobljene v njihovih eksperimentalnih študijah:
-Amoniak-ogljik (tip I)
-Dušikov-Zeoliti (tip I)
-Vodikov-ogljik pri visokih temperaturah (tip I)
-Osvoji neegra premoga (tipa I)
-Silicijev dušik (tip II)
-Nitrogen-hierro (tip II)
-Silicijev silicijev bromo-gel (tip III)
-Pare iz silicijevega joda (tip III)
-Dušik-politični (tip III)
-Kripton-negra premoga (tip IV)
-Benzene-gel železovega oksida (tip IV)
-Vodni parni ogljik (tip V)
Upoštevajte, da so bili omenjeni trdni snovi premog, črni premog, kovinsko železo, železovi oksid, zeoliti in silikageli. Vsi so dobri primeri adsorbentov z različnimi industrijskimi aplikacijami.
Reference
- Walter J. Moore. (1963). Fizikalna kemija. V termodinamiki in kemičnem ravnovesju. (Četrti izd.). Longmans.
- Iran. Levine. (2009). Načela fizikalnokemije. Šesta izdaja, stran 479-540. MC Graw Hill.
- Glasstone. (1970). Učbenik fizikalne kemije. Druga izdaja. D. Van Nostrand, podjetje, Inc.
- Enota 3. Površinski pojavi. (s.F.). Adsorpcija. [PDF]. Okreval od: depa.Fquim.Ne.mx
- Lowell s., Shields J.In. (1984) Adsorpcijske izoterme. V: Površina praška in poroznost. Springer, Dordrecht.
- Elsevier b.V. (2020). Adsorpcijska izoterma. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Wikipedija. (2020). Adsorpcija. Pridobljeno iz: v.Wikipedija.org

