Ionizacija v konceptu, procesu in primerih za fiziko in kemije

- 1816
- 39
- Raymond Moen
The ionizacija Je vse ta postopek, v katerem nastajajo električne obremenitve iz nevtralnih delcev. To se lahko zgodi z različnimi naravnimi mehanizmi ali silami, bodisi z sevanjem, toploto, električnimi polji, magnetnimi polji ali kemičnimi reakcijami. Ioni se proizvajajo kot posledica, ki so pozitivno ali negativno obremenjeni atomi.
Ionizacija je temeljni postopek za simfine fizikalnih, kemičnih ali naravnih pojavov, pri čemer je slednja večkrat mešanica fizikalno -kemijskih sprememb. Na primer, v fizikalnih ionizacijah se načeloma ne pojavijo kemične reakcije; To pomeni, da proizvodnja ionov ne pomeni razčlenitve ali oblikovanja novih povezav.
 Številni naravni pojavi, kot so severne luči, temeljijo na ionizaciji molekul atmosfere. Vir: Pixabay.
Številni naravni pojavi, kot so severne luči, temeljijo na ionizaciji molekul atmosfere. Vir: Pixabay. Vendar v naravnih pojavih to ionizacijo običajno spremljajo kemične reakcije, kot je nastajanje ozona na nizki nadmorski višini. Tudi med nevihtami nastanejo dušikovi oksidi zaradi žarkov in njihovih intenzivnih temperatur, ki oksidirajo dušik zraka.
Po drugi strani se lahko ionizacija prikrade: znotraj iste vode, v drgnjenju med dvema površinama, v oksidacijah kovin ali v raztapljanju nekaterih plinov v vodi.
[TOC]
Kemijska ionizacija
Zmanjšanje oksidacije
 Med delovanjem baterij igrače so ioni in elektroni nenehno. Vir: D J Shin/CC by-SA (https: // createCommons.Org/licence/by-sa/3.0
Med delovanjem baterij igrače so ioni in elektroni nenehno. Vir: D J Shin/CC by-SA (https: // createCommons.Org/licence/by-sa/3.0 V kemični ionizaciji se ioni proizvajajo z lomljenjem ali tvorbo povezav. Dve snovi nepovratno zaslužita ali izgubita elektrone: tisti, ki izgubi elektrone, pridobi pozitivno obremenitev, medtem ko tisti, ki zmaga, ohrani negativno obremenitev.
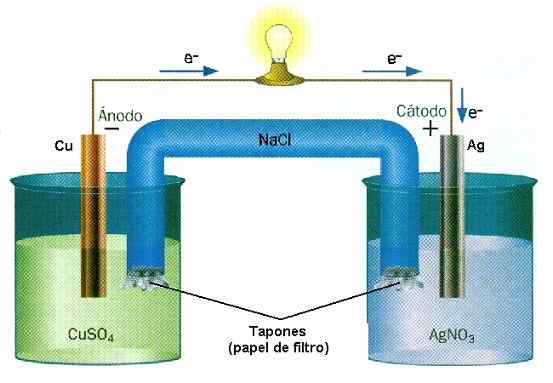
 Primer zmanjšanja reakcije oksida v kupu Cu-Ag. Vir: vodna stena/cc by-sa (http: // creativeCommons.Org/licence/by-sa/3.0/)
Primer zmanjšanja reakcije oksida v kupu Cu-Ag. Vir: vodna stena/cc by-sa (http: // creativeCommons.Org/licence/by-sa/3.0/) V baterijah snov izgubi elektrone, medtem ko jih drugi osvoji. Ti elektroni potujejo in aktivirajo električna vezja opreme, da se končno vrnejo v drugi predal za kup, kjer jih čaka druga snov, da jih ujamejo in naložijo negativno. To je primer kemične ionizacije, ki jo izvede reakcija redukcije oksida.
Vam lahko služi: glukonska kislina: struktura, lastnosti, sinteza, uporabaHeterolitična ruptura
Druga vrsta kemične ionizacije je posledica heterolitske rupture. Ko pride do tega preloma, je povezava A-B pokvarjena, da tvori ione na+ in b-, Ker so elektroni usmerjeni proti atomu, za katerega "čutijo" večjo afiniteto. Heterolitska ruptura je ponavadi prvi korak, ki ureja mehanizme številnih organskih reakcij.
Selfieinizacija
Električne obremenitve se ne morejo pojaviti samo v gibanju elektronov, ampak tudi s povezavami, ki so pokvarjene ali se oblikujejo v izmenjavi atomov. To je primer samo -selizacije, ki se zgodi med dvema molekulama iste spojine.
Od vseh kemičnih ionizacij je samo -najpreprostejša in najbolj neopazna, saj nima sposobnosti vodenja električnega toka sam po sebi.
Ionizacija v fiziki
Statična elektrika
 Lasje te deklice se zaradi statične električne energije medsebojno zaračunajo in odbijajo drug drugega. Vir: BiseUp Ganguly/CC by (https: // creativeCommons.Org/licence/by/3.0
Lasje te deklice se zaradi statične električne energije medsebojno zaračunajo in odbijajo drug drugega. Vir: BiseUp Ganguly/CC by (https: // creativeCommons.Org/licence/by/3.0 Ionizacija ima tudi veliko sodelovanja v fizičnih pojavih. Na splošno ionizacija fizike ne pomeni kemijskih reakcij. Atomi snovi se nabijejo električno, ne da bi izgubili prvotno identiteto.
Površine lahko izmenjajo elektrone, ko drgnejo, če je eden od njih učinkovitejši pri njihovem skladišču, kar vodi v statično elektriko. Ni več govora o atomih, ampak o celotnem materialu, ki pridobi negativno ali pozitivno obremenitev in da lahko ob obnovo ravnotežja električni šok dobesedno ustvari med dvema materialom ali telesi.
Plinasta ionizacija
Razpršeni plinasti atomi lahko izgubijo elektrone, če so podvrženi električnemu polju. Pri tem so atomi navdušeni in sproščajo elektrone. Potem, ko se ohlajajo in se vračajo k njihovemu statusu manjše energije, se fotoni poslovijo. In postopek se znova in znova ponavlja. Rezultat: vir razsvetljave ali električne energije.
Vam lahko služi: bonski oksid (B2O3): kaj je, struktura, lastnosti, uporabeIonizacija sevanja ali trkov
Podobno lahko snov pridobi energijo, ki jo zagotavljajo različne vrste sevanja (gama, x -roji, ultravijolični itd.) ali s trkom z visoko energijskimi delci (alfa, beta in nevtroni).
Prispevana energija je takšna, da je elektron atoma takoj. Ta vrsta ionizacije je povezana z več radioaktivnimi in kozmičnimi pojavi.
Vodna ionizacija
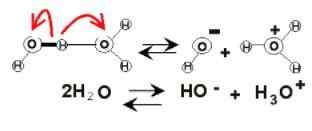 Disociacija vode
Disociacija vode V vodni barvi se lahko zaradi ionizacije pojavijo električni naboji. To je kemikalije, saj dve molekuli vode nenadoma reagirata drug na drugega, da se disociirata in ustvarjata H ione3Tudi+ in oh-:
2H2Ali (l) ⇌ h3Tudi+(AC) + OH-(AC)
To ravnovesje je bilo zelo razseženo proti vodi, tako da skoraj ni nobene zaničevalne količine teh ionov.
Zračna ionizacija
Molekule zraka ne sodelujejo v nobenem ravnovesju samo -samo -. Kisik, dušik, argon, vodna para in drugi plini, ki sestavljajo zrak, ne izmenjujejo atomov ali elektronov. Zato zrak v normalnih pogojih ni dober električni prevodnik.
Če pa je podvržen električnemu polju, sevanju ali intenzivnih temperaturah, je lahko ion in postane dober voznik. To se zgodi na primer, ko električni žarki padejo iz oblakov na zemljo in potujejo po elektroni po zraku z nenadno svetlobno eksplozijo.
Primeri ionizacije
V prejšnjih razdelkih so bili imenovani nekateri primeri ionizacije. Končno bodo omenjeni nekateri drugi.
Kovinska oksidacija
Ko kovine oksidirajo, bodisi z delovanjem zemeljskega kisika bodisi z napadom kislih snovi, pridobijo pozitivne naboje, da tvorijo okside ali soli.
Lahko vam služi: Kemični postopek: načela, vrste, primeriNa primer, železo je ionizirano zahvaljujoč kisiku, da se preoblikuje v vere3+, Nahaja se v kristalih železovih oksidov. Magnezij se na drugi strani raztopi v žveplovi kislini, da izgubi elektrone in ostane kot Mg ioni2+ V magnezijevem sulfatnem soli.
Raztapljanje gaze v vodi
Nekateri plini, kot sta amonijak in vodikov klorid, se v vodi raztopijo, da izgubijo nevtralnost in povzročijo nastanek ionov. Na primer amonijak, ko se raztopi delno sprošča NH ione4+ in oh-. Medtem bo vodikov klorid pri raztapljanju ustvaril h ione3Tudi+ in Cl- popolnoma.
Podoben primer je raztapljanje soli v vodi, kot je magnezijev sulfat, MGSO4. Vendar MG ioni2+ In tako42- So že prisotni pri solnih kristalih, preden se raztopijo v vodi.
Svetlobne svetilke ali cevi

V parnih svetilkah ali osvetljenih cevi so plinasti atomi z električnimi udarci navdušeni, da proizvajajo določeno količino svetlobe in barv. Na primer, ta ionizacija poteka v natrijevih ali živosrebrnih svetilkah, pa tudi v znanih neonskih lučeh s svojimi svetlimi barvami v restavracijah ali vpisi v trgovino.
Ionizacijske energije
Preučujemo ionizacijsko energijo, ki je periodična lastnost, da bi označili kemijske elemente glede na enostavnost, s katero njihovi plinasti atomi podarijo svoje elektrone za pozitivno obremenitev. Tako imajo na primer kovine ponavadi najnižje ionizacijske energije, medtem ko nemetalni elementi in plemeniti plini, najvišji.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Serway, r., Jewett, J. (2008). Fizika za znanost in inženiring. Zvezek 1. 7. Izdaja. Mehika. Uredniki učenja Cengage.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Ionizacija. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (17. oktober 2016). Ionizacija. Encyclopædia Britannica. Okrevano od: Britannica.com
- Doug Stewart. (2018). Opredelitev ionizacije: kaj je ionizacija? Okrevano od: Chemicool.com
- John Zavisa. (1. april 2020). Kako deluje strela. Okrevano od: znanost.Kakovostno delo.com
- « 18 vrst vedenja in njihove značilnosti (s primeri)
- Izvor rumenega liberalizma, značilnosti, vzroki, posledice »

