Nikelj hidroksid (III) struktura, lastnosti, uporabe, tveganja
- 2715
- 786
- Roman Schamberger
On Nikelj hidroksid (III) To je anorganska spojina, kjer ima nikljeva kovina oksidacijsko število 3+. Njegova kemična formula je ni (OH)3. Glede na posvetovane vire doslej še ni bilo mogoče preveriti obstoja nikljevega hidroksida (III) ali (OH)3, Toda nikelj okso-hidroksid (III), otrok (OH) je bil pridobljen.
Nikelj (iii) nio (OH) oksohidroksid je črna kristalna trdna snov, ki kristalizira na dva načina: beta oblika in gama. Najpogostejša kristalna oblika (OH) je beta.
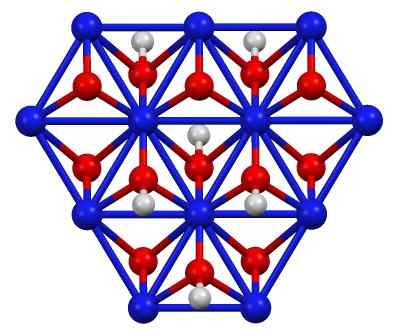
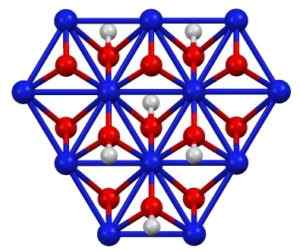 Nikelj oksihidroksid struktura (III), otrok (OH). Modra = nikelj, rdeča = kisik, bela = vodik. Avtor: Smokefoot. Vir: lastno delo. Vir: Wikipedia Commons
Nikelj oksihidroksid struktura (III), otrok (OH). Modra = nikelj, rdeča = kisik, bela = vodik. Avtor: Smokefoot. Vir: lastno delo. Vir: Wikipedia Commons Otroka (OH) lahko dobite z oksidacijskimi raztopinami nikljevega nitrata (ii) (ali (ne3)2) s klorom (Cl2) ali bromina (Br2) V prisotnosti kalijevega hidroksida (KOH). Nikelj (iii) oksohidroksid je zelo topen v kislinah. Ima uporabo v nikljevih baterijah, v Superca.
Nikelj (iii) nio (OH) in nikljalni hidroksid (ii) ali (OH) (OH)2 Združeni so pri delovanju večine svojih aplikacij, saj sta oba del enake enačbe oksida-redukcije.
Otrok (OH) je enaka tveganja drugih nikljevih soli, to je draženje kože ali dermatitis in rak.
[TOC]
Kristalna struktura
Nikelj oksohidroksid (III) kristalizira na dva načina: beta in gama. Oblika beta β-nio (OH) ima strukturo, ki je zelo podobna β-ni (OH)2, kar se zdi logično, ker prvo izvira iz oksidacije slednjega.
Oblika γ-nio (OH) gama je oksidacijski produkt nikljevega hidroksida (II) v obliki alfa, α-ni (OH)2. Tako kot slednje ima tudi gama strukturo plasti z alkalnimi kovinskimi ioni, anioni in vodo, prepleteno med plastmi.
Elektronska konfiguracija
V otroku (OH) nikelj najdemo v stanju oksidacije 3+, kar pomeni, da 3 elektroni manjkajo v njegovih najbolj oddaljenih plastehs in elektron iz plasti 3d. Elektronska konfiguracija ni3+ V otroku (OH) je: [ar] 3d7, Kjer je [AR] elektronska konfiguracija plemenitega argonskega plina.
Lahko vam služi: pi povezavaNomenklatura
- Nio (OH): nikelj oksohidroksid (iii)
- Nikelj črna
Lastnosti
Fizično stanje
Črno kristalno trdno.
Topnost
Nio (OH) oksohidroksid je zelo topen v kislinah. Gama faza se raztopi v žveplovi kislini z evolucijo kisika.
Druge lastnosti
V vroči vodi postane oksohidroksid niklja (II) in (iii), ali3Tudi2(OH)4.
Razpade na 140 ° C v niklu (ii) (otroški in kisikov oksid.
Gama fazo (γ-nio (OH)) lahko dobimo na več načinov, na primer, da nikelj zdravimo z staljeno mešanico natrijevega peroksida (NA2Tudi2) in natrijev hidroksid (NaOH) pri 600 ° C in hlajenje v ledeni vodi.
Faza gama se razgradi, ko se segreje na 138 ° C.
Prijave
V nikljevih baterijah
Edisonova nikelj-hidrovska baterija, v kateri se KOH uporablja kot elektrolit, temelji na reakciji niklja oksihidroksida (III) z železom:
Prenesi:
Fe + 2nio (OH) + H2Ali ⇔ vera (oh)2 + 2ni (OH)2
Breme:
Gre za reverzibilno reakcijo redukcije oksida.
V anodi teh baterij se pojavi vrsta kemičnih in elektrokemijskih procesov. Spodaj je splošna shema:
Prenesi
β-ni (OH)2 ⇔ β-nio (OH) + H+ + in-
Breme
Staranje ↑ ↓ preobremenitev
Prenesi
α-ni (OH)2 ⇔ γ-nio (OH) + H+ + in-
Breme
Vam lahko služi: arzen: zgodovina, struktura, lastnosti, uporabeV tehnologiji niklja akumulatorja se nikelj oksohidroksid (III) Nio (OH) imenuje "nikljeva aktivna masa".
 Nikelj polnilne baterije. Avtor: Superusergeneric. Vir: lastno delo. Vir: Wikipedia Commons.
Nikelj polnilne baterije. Avtor: Superusergeneric. Vir: lastno delo. Vir: Wikipedia Commons. V elektrokatalizi kot refenirani katalizator
Otrok (OH) je bil uspešno uporabljen v elektrosintezi azopirazolov z elektrokatalitno oksidacijo aminopirazolov. Njegova uporabnost pri sintezi karboksilnih kislin, ki se začnejo iz alkoholov ali karbonilnih spojin, je bila tudi dokazana.
 Pridobivanje karboksilne kisline z oksidacijo alkohola, ki ga katalizira otrok (OH). Vir: Prvotno iz.Wikipedija. Originalni avtor uploader je bil v8rik v in.Wikipedija. Vir: Wikipedia Commons
Pridobivanje karboksilne kisline z oksidacijo alkohola, ki ga katalizira otrok (OH). Vir: Prvotno iz.Wikipedija. Originalni avtor uploader je bil v8rik v in.Wikipedija. Vir: Wikipedia Commons Drug primer je kvantitativna pretvorba hidroksimetipiridina v piridokarboksilno kislino. V tem primeru je jeklena ali nikljeva elektroda, ki ustreza anodi, prekrita s plastjo otroka (OH). Medij, v katerem se izvaja elektroliza, je alkalna.
V teh reakcijah otrok (OH) deluje kot mediator za zmanjšanje ali "redoks" mediator.
Elektroliza se izvaja v celici z nikljevo anodo in titanovo katodo, v alkalnem mediju. Med postopkom se oblikuje ali (OH)2 Na površini anode niklja, ki se hitro oksidira do otroka (OH):
Ni (oh)2 + Oh- - in- ⇔ nio (OH) + H2Tudi
Otrok (OH) reagira z organskim substratom in dobimo želeni organski izdelek, ki regenerira ni (OH)2:
Nio (OH) + organska spojina → ni (OH)2 + izdelek
Ko se ni (OH) regenerira2, Reakcija katalize se nadaljuje.
Uporaba otroka (OH) kot elektrokatizatorja omogoča pridobivanje organskih spojin z nizkimi stroški in na okolju prijazen način.
V super kartici
Otrok (OH) skupaj z ni (OH)2 Predstavljajo odlične materiale za super jeze (angleško SuperCapacitos).
Ni (oh)2 + Oh- ⇔ nio (OH) + H2Ali + e-
Imajo visoko kapacitivnost, nizke stroške in po nekaterih referencah pod vplivom na okolje.
 Kondenzatorji v elektronskem vezju. Avtor: pdphotos. Vir: Pixabay.
Kondenzatorji v elektronskem vezju. Avtor: pdphotos. Vir: Pixabay. Vendar imajo nizko prevodnost. To se rešuje z nanodelci omenjenih spojin, saj tako poveča površino in zmanjša razdaljo, potrebno za difuzijo, kar zagotavlja veliko hitrost prenosa elektronov in/ali ionov.
Vam lahko služi: elastični materialiPri oksidaciji kovinskih ionov
Ena od komercialnih aplikacij nikljevega oksohidroksida (III) temelji na njegovi sposobnosti oksidiranja kobaltnih ionov (II) v raztopini kobaltnih ionov (III).
Tveganja
V raztopini je nikkel bolj stabilen kot ion oz2+, Zato ni običajno, da pridete v stik z Ni3+. Vendar so previdnostni ukrepi enaki, saj lahko niklja, bodisi kovinski, v raztopini ali v obliki trdnih soli, povzroči preobčutljivost kože.
Priporočljivo je uporabljati zaščitno opremo in oblačila, kot so obrazni ščitnik, rokavice in varnostni čevlji. Vse to je treba uporabiti vsakič, ko obstaja možnost stika z nikljevimi rešitvami.
Če pride do dermatitisa, je treba zdraviti z zdravnikom, da izključi, da ga povzroča nikelj.
Kar zadeva možnost vdihavanja, je dobra praksa.
Vse nikljeve spojine razvrsti Mednarodna raziskovalna agencija za raka ali IARC (kratica za angleščino Mednarodna agencija za raziskave raka), v kategoriji rakotvornice za človeka.
To temelji na epidemioloških in eksperimentalnih podatkih.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Lyalin, b.V. et al. Elektrosinteza azopirazolov z oksidacijo N-allkaliraminopirazolov na otroški (OH) anodi v vodni alkali-a zeleni metodi za N-N homokuple. Tetrahedronske črke. 59 (2018) 2741-2744. Okrevano od Scientirect.com.
- Liuyang, Zhang in sod. (2018). Materiali na osnovi niklja za superkapacitos. Materiali danes. Okrevano od Scientirect.com
- Ettel, v.Do. in mosolu, m. Do. (1977). Priprava niklja črne barve. Ali.S. Patent št. 4.006.216. 1. februar 1977.
- Scharbert, b. (1993). Postopek za oksidacijo derivatov hidroksimetilpiridina do derivatov piridinekarboksilne kisline pri anodah nikljevega oksida hidroksida. Ali.S. Patent št. 5,259,933. 9. november 1993.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 17. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek pri 17. VCH Verlagsgellschaft MBH.
- McBreen, James. (1997). Nikelj hidroksidi. V priročniku baterijskih materialov. VCH založnik. Okreval od Osti.Gov.
- « Zgodovina, značilnosti, uporabe, primeri makromatorjev, primeri
- Predstavljeni analogni računalniki, komponente, vrste »

