Struktura magnezijevega hidroksida, lastnosti, nomenklatura, uporablja

- 3324
- 306
- Ms. Pablo Lebsack
On Magnezijev hidroksid To je anorganska spojina, katere kemijska formula je MG (OH)2. V svoji čisti obliki je bela trdna trdnost brez svetlosti in amorfnega videza; Vendar pa se z majhno in natančno vsebnostjo nečistoč spremeni v kristalno trdno brucito, mineral, ki je v določenih nahajališčih v naravi in je bogat vir magnezija.
Je šibek elektrolit ali baza, zato je njegova disociacija nizka v vodi. Ta lastnost naredi MG (OH)2 dober kislost nevtralizator za prehrano ljudi; Popularno znano zdravilo kot vzmetenje mleka iz Magnezije. To je tudi požarni zaostanek, tako da med toplotno razgradnjo sprošča vodo.
 Vzorec trdnega magnezija hidroksida. Vir: Chemical Interest [javna domena]
Vzorec trdnega magnezija hidroksida. Vir: Chemical Interest [javna domena] Na zgornji sliki je prikazano nekaj trdnih snovi magnezijevega hidroksida, v katerih je mogoče videti njegovo neprozorno belo barvo. Več kristalnih so, razvijejo steklene in bisere površine.
Njegova kristalna struktura je značilna, saj vzpostavlja šesterokotne kristale z dvojnim slojem, ki so obetavni modeli za oblikovanje novih materialov. V teh plasteh imajo njihove pozitivne obremenitve pomembno vlogo zaradi zamenjave MG2+ s trivalentnimi kationi in vrstami, omejenimi med stenami, sestavljenimi iz OH anionov-.
Po drugi strani pa druge aplikacije izhajajo, odvisno od morfologije pripravljenih delcev ali nanodelcev; kot katalizatorji ali adsorbenti. V vseh njih je razmerje 1: 2 za Mg ione konstantno2+: Oh-, odraža v isti MG formuli (OH)2.
[TOC]
Struktura
Formula in oktaedro
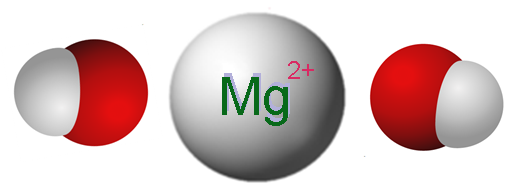 Ioni, ki sestavljajo magnezijev hidroksid. Vir: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Ioni, ki sestavljajo magnezijev hidroksid. Vir: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Vrhunska slika prikazuje ione, ki sestavljajo MG (OH)2. Kot je razvidno, obstajata dva aniona oh- Za vsako kation mg2+, ki elektrostatično delujejo, da definirajo šesterokotno strukturno kristal. Ista formula kaže, da je razmerje Mg: OH 1: 2.
Vendar je prava kristalna struktura nekoliko bolj zapletena kot prevzeti preproste Mg ione2+ in oh-. Pravzaprav je za magnezij značilno, da ima koordinacijsko številko 6, tako da lahko deluje z do šest OH-.
Tako se oblikuje oktaedron mg (OH)6, kjer atomi kisika očitno izvirajo iz OH-; in kristalna struktura zdaj temelji na upoštevanju takšnih oktaedrov in kako medsebojno komunicirajo.
Pravzaprav MG (OH) enote6 Na koncu določijo dvojne strukture, ki so v prostoru naročene v vesolju, da povzročijo šesterokotno steklo.
Vam lahko služi: atomska težaDvojna plast
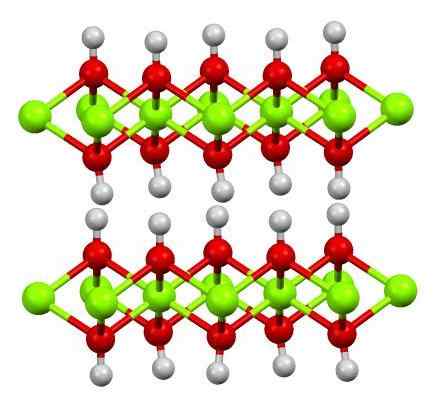 Dvojna plast magnezijevega hidroksida. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Dvojna plast magnezijevega hidroksida. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Zgornja slika prikazuje dvojno plast magnezijevega hidroksida (LDH) Slavni dvojni hidroksidi). Zelene sfere predstavljajo mg ione2+, ki bi jih lahko nadomestili drugi večje obremenitve, da bi ustvarili pozitivno obremenitev v plasti.
Upoštevajte, da okoli vsakega mg2+ Obstaja šest rdečih sfer, povezanih z njihovimi belimi sferami; Se pravi, oktaedrske enote MG (OH)6. Oh- Deluje kot most, da se pridruži dvema MG2+ različnih ravnin, zaradi česar so plasti omejeni.
Prav tako opazimo, da vodikovi atomi kažejo navzgor in navzdol in so prvi odgovorni za medmolekularne sile, da obe plasti enot Mg (OH) ohranijo skupaj6.
Med temi plastmi, nevtralne molekule (kot so alkoholi, amoniak in dušik) ali celo anioni, odvisno od tega, kako pozitivni so (če so ioni3+ ali vera3+ Zamenjava Mg2+). "Polnjenje" teh vrst omejujejo površine, sestavljene iz OH anionov-.
Morfologije
Šesterokotno in dvojno steklo raste počasi ali hitro. Vse je odvisno od parametrov sinteze ali priprave: temperature, molskega razmerja, vznemirjenosti, topil, reagentov kot vira magnezija, baz ali oborilnih sredstev itd. Ko steklo raste, določite mikrostrukturo ali morfologijo svojih nanodelcev ali agregatov.
Tako imajo lahko ti nanodelci posode, trombocite ali cvetačo. Prav tako se lahko spremeni porazdelitev njegovih velikosti, pa tudi stopnja poroznosti nastalih trdnih snovi.
Lastnosti
Fizični videz
Je bela, granulirana ali v prahu in stranišče.
Molarna masa
58.3197 g/mol.
Gostota
3,47 g/ml.
Tališče
350 ° C. Pri tej temperaturi se v oksidu razgradi tako, da sprosti molekule vode, vsebovane v njihovih kristalih:
MG (OH)2(s) => mgO (s) +h2O (g)
Topnost vode
0,004 g/100 ml pri 100 ° C; To pomeni, da se komaj uspe raztopiti v vreli vodi, zato je netopna spojina v vodi. Vendar pa se z zmanjšanjem pH (ali povečanjem kislosti) njegova topnost poveča s tvorbo kompleksnega acuo -a, MG (OH2)6.
Po drugi strani pa, če je MG (OH)2 je absorbiral co2, sprosti plin, ki se zadržuje kot šumenja pri raztapljanju v kislem mediju.
Vam lahko služi: helij: zgodovina, lastnosti, struktura, tveganja, uporabeLomni količnik
1.559
ph
Vodna suspenzija ima pH, ki se giblje med 9,5 in 10,5. Čeprav so te vrednosti normalne, odraža njegovo malo bazičnost proti drugim kovinskim hidroksidom (kot je NaOH).
Toplotna zmogljivost
77.03 j/mol · k
Kje je?
 Blue Brucita Blue Blut. Vir: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Blue Brucita Blue Blut. Vir: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Magnezijev hidroksid lahko v naravi najdemo kot mineral Brucita, za katerega je značilna prozorna bela barva, z zelenimi ali modrikastimi toni. Prav tako je Brucita del nekaterih gline, kot je klorit, pri prepletu med plastmi silikatov, ki so se jim pridružili kovinski ioni.
V La Brucita obstajajo tudi drugi ioni poleg MG2+, kot Al3+, Vera3+, Zn2+ in Mn2+. Njihove MENas lahko najdemo v različnih regijah ali jezerih Škotske, Kanade, Italije in ZDA.
Fizično vidijo njihovi kristali.
Ta mineral je eno od zla, ki vplivajo na cemente in beton, saj se v njih ponavadi širi in povzroča zlome. Vendar ne absorbira co2, Torej njegova kalcinacija ne prispeva k učinku toplogrednih plinov, zato je ustrezen mineraloški vir (in najbogatejši), da dobimo magnezij, poleg morske vode.
Nomenklatura
MG (OH)2 Ima do tri imena, ki jih je IUPAC sprejel (iz mineralogije ali medicine). Ti so zelo podobni drug drugemu, saj se kot končajo.
Na primer, "magnezijev hidroksid" ustreza njegovemu imenu v skladu z nomenklaturo zalog, na koncu pa izpusti (II), ker je +2 skoraj privzeto edino stanje oksidacije magnezija.
'Magnezijev dihidroksid', ki kaže z grškim števcem predpono Število OH ionov- navedeno v formuli v skladu s sistematično nomenklaturo. In "magnetni hidroksid", ki se konča s pripono -ico, da je največ in "edinstveno" stanje oksidacije magnezija, v skladu s tradicionalno nomenklaturo.
Druga imena, kot sta Brucita ali Magnesia Milk, čeprav so neposredno povezana s to spojino, se nanjo ni priročno sklicevati, ko gre za najčistejšo trdno snov ali kot anorganska spojina (reagent, surovina, etc.).
Prijave
Nevtralizator
MG (OH)2 Zaradi nizke topnosti v vodi je dejstvo, da gre za odličen nevtralizator kislosti; V nasprotnem primeru bi medij temeljil pri prispevanju velikih koncentracij OH ionov-, kot druge baze (močni elektroliti).
Vam lahko služi: kemična hibridizacijaTako MG (OH)2 komaj sprosti oh-, Hkrati reagira s H ioni3Tudi+ Oblikovati magnezijev kompleks, ki je bil omenjen tudi zgoraj. Če je sposobna nevtralizirati kislost vodnih medijev, je namenjena čiščenju odpadne vode.
Je tudi dodatek hrane, gnojil in nekaterih osebnih higienskih izdelkov, kot je zobna pasta, saj se njegova kislost zmanjšuje.
Antacid
Ker je malo topna v vodi, ga je mogoče jemati, ne da bi tvegal učinke svojih OH ionov- (Zelo malo disociatov kot šibki elektrolit).
Ta značilnost, povezana s poddelam od zgoraj.
Po drugi strani pa magnezijsko mleko pomaga tudi pri boju proti nadležnim facijam (bele in pordelosti, ki se pojavljajo v ustih).
Ogenj retardant
V razdelku Properties je bilo omenjeno, da je MG (OH)2 Razbije sproščanje vode. Natančno taka voda pomaga ustaviti napredek plamena, saj absorbirajo toploto, da se izhlapijo in posledično razredčijo vnetljive ali vnetljive pline.
Mineral Brucita se v ta namen običajno uporablja industrijsko, ki je namenjena izpolnjevanju nekaterih materialov, kot so plastika različnih polimerov (PVC, smole, gumarice), kabli ali stropi.
Katalizator
MG (OH)2 Sintetizirani kot nanoplakete se je izkazalo za učinkovito za kataliziranje kemičnih zmanjšanj; Na primer 4-nitrofenol (ph-no2) 4-aminofenol (PH-NH2). Imajo tudi antibakterijsko delovanje, zato bi ga lahko uporabili kot terapevtsko sredstvo.
Adsorbent
Nekaj mg (OH) trdnih snovi2 Lahko so precej porozni, odvisno od načina njihove priprave. Zato se prijavijo kot adsorbenti.
V vodnih raztopinah lahko adsorbirajo (na svojih površinah) molekule za barvanje in razjasnijo vodo. Na primer, lahko adsorbirajo barvilo indigo karmina, ki je prisotno v vodnih tokovih.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Hidroksidni magnezij. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Hidroksidni magnezij. Baza podatkov Pubchem. Cid = 14791. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Ametist galerije. (2014). Mineralni brucit. Obnovi se od: galerije.com
- Henrist in sod. (2003). Morfološka študija nanodelcev magnezijevega hidroksida
- Obupno v razredčeni vodni raztopini. Journal of Crystal Growth 249, 321-330.
- Saba j., Shanza R. K., Muhammad r. S. (2018). Sinteza in strukturna analiza mezoporoznih magnezijevih hidroksidnih nanodelcev kot učinkovitega katalizatorja.
- Thimmasandra Narayan Ramesh in Vani Pavada Sreenivasa. (2015). Odstranjevanje indigo carmina barvila iz vodne raztopine z uporabo magnezijevega hidroksida kot adsorbenta. Journal of Materials, Vol. 2015, ID članka 753057, 10 strani. doi.org/10.1155/2015/753057

