Struktura aluminijevega hidroksida, lastnosti, uporabe, tveganja
- 4611
- 985
- Mr. Shane Larkin
On Aluminijast hidroksid To je anorganska spojina, katere kemijska formula je (OH)3. Za razliko od drugih kovinskih hidroksidov je amfotero, ki se lahko reagira ali obnaša kot kislina ali baza, odvisno od medija. Je precej netopna bela trdna snov v vodi, zato se uporablja kot sestavni del antacidov.
Kot MG (OH)2 ali brucita, s katero ima določene kemijske in fizikalne lastnosti, je povsem videti kot amorfna in sijajna trdna; Ko pa kristalizira z nekaterimi nečistosti, pridobi kristalne oblike, kot da bi bile bisere. Med temi minerali naravni viri Al (OH)3, je Gibbsita.
 Poseben kristal Gibbsita. Vir: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Poseben kristal Gibbsita. Vir: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Poleg Gibbtea so tudi minerali Bayerite, Nordstranditi in Doleyíta, ki tvorijo štiri aluminijeve hidroksidne polimorfije. Strukturno sta si zelo podobna drug drugemu in se med seboj razlikujejo na način, kako se nahajajo ali združijo plasti ali ionski listi, pa tudi vrsta nečistoč.
Če nadzorujemo parametre pH in sinteze, lahko pripravite katero koli od teh polimorfov. Prav tako lahko nekatere kemične vrste, ki jih zanimajo, prepletajo med njihovimi plastmi, tako da se ustvarijo materiali ali spojine prepletenja. To predstavlja uporabo več tehnološkega pristopa do AL (OH)3. Njegove druge uporabe so kot antacidi.
Po drugi strani se uporablja kot surovina za pridobivanje glinice, njeni nanodelci pa so bili uporabljeni kot katalitična podpora.
[TOC]
Struktura
Formula in oktaedro
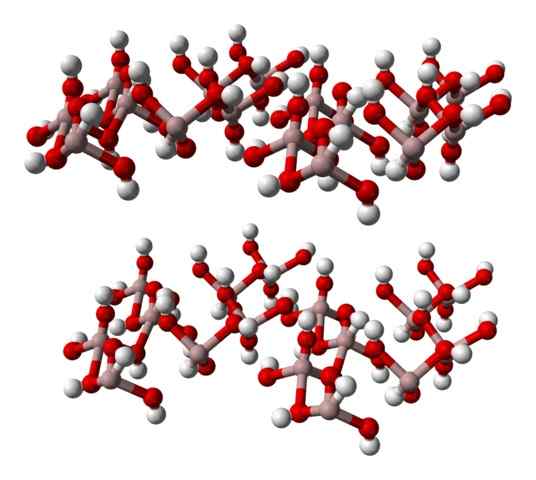
Kemična formula pri (OH)3 Označuje enkrat odnos do3+: Oh- Je 1: 3; to pomeni, da obstajajo trije anioni oh- za vsako kation do3+, kar je isto, kot da pravi, da tretji del ionov ustreza aluminiju. Torej, al3+ in oh- Elektrostatično delujejo, dokler njihove atrakcije-repulzije ne določijo šesterokotnega kristala.
Vendar al3+ Ni nujno, da ga obkrožajo trije OH- Toda šest; Zato se govori o koordinacijskem oktaedronu, na (OH)6, v katerem je šest interakcij al-o. Vsak oktaedron predstavlja enoto, s katero je zgrajeno steklo, in številne sprejmejo triklinične ali monoklinične strukture.
Spodnja slika delno predstavlja oktaedre do (OH)6, Ker so za samo štiri interakcije opažene3+ (svetlo rjave sfere).
 Šesterokotno steklo Gibbsite, aluminijev mineral hidroksida. Vir: Benjah-BMM27 [javna domena].
Šesterokotno steklo Gibbsite, aluminijev mineral hidroksida. Vir: Benjah-BMM27 [javna domena]. Če je ta struktura skrbno opažena, kar ustreza strukturi minerala Gibbse, je mogoče predvidevati, da bele sfere integrirajo "obraze" ali površine ionskih plasti; To so vodikovi atomi OH ionov-.
Vam lahko služi: najem halogenuros: nepremičnine, pridobivanje, primeriUpoštevajte, da obstajata plast A in še en B (prostorsko nista enaka), skupaj s vodikovimi mostovi.
Polimorfi
Sloji A in B nista vedno povezana na enak način, pa tudi njihova fizična okolja ali gostujoči ioni (soli) se lahko spremenijo. Posledično kristali Al (OH)3 Se razlikujejo v štirih mineraloških oblikah ali v tem primeru polimorfni.
Nato se reče, da ima aluminijev hidroksid do štiri polimorfe: gibbsite ali hidragilit (monoklinic), Bayerit (monoklinic), Doyleíta (tricikliranje) in Nordstrandit (Trichlinic). Od teh polimorfov je Gibbsita najbolj stabilna in obilna; Ostali so razvrščeni kot redki minerali.
Če bi kristale opazili na mikroskopu, bi bilo videti, da je njihova geometrija šesterokotna (čeprav nekoliko nepravilna). PH igra pomembno vlogo pri rasti takšnih kristalov in nastale strukture; to pomeni, da lahko tvori pH a polimorf ali drugo.
Na primer, če se medij, kjer se AL (OH) obori3 Ima pH manj kot 5,8 Gibbsita; Medtem ko je pH večji od te vrednosti, se oblikuje Bayerita.
V bolj osnovnih medijih se kristali Nordstrandita in Doyleíta ponavadi oblikujejo. Tako je, da je najbolj obilen gibbsite, dejstvo, ki odraža kislost njenih vremenskih razmer.
Lastnosti
Fizični videz
Bela trdna snov, ki lahko prihaja v različnih oblikah: granulirano ali prah, in amorfni videz.
Molarna masa
78.00 g/mol
Gostota
2,42 g/ml
Tališče
300 ° C. Nima vrelišča, ker hidroksid izgubi vodo, da se preoblikuje v aluminino ali aluminijevo oksid, v2Tudi3.
Topnost vode
1 · 10-4 G/100 ml. Vendar se njegova topnost poveča z dodajanjem kislin (h3Tudi+) ali alkalis (oh-).
Izdelek za topnost
Ksp = 3 · 10−34
Ta majhna vrednost pomeni, da se le majhen del raztopi v vodi:
Al (OH)3(sol3+(Ac) +3oh-(AC)
In pravzaprav ta zaničljiva topnost omogoča dober nevtralizator kislosti, saj želodčnega okolja ne temelji preveč, ker ne sprošča skoraj ionov OH-.
Anfoterizem
Al (OH)3 Zanj je značilen njegov lik amfoterja; to pomeni, da lahko reagira ali se obnaša, kot da bi bila kislina ali baza.
Na primer, reagirajte s H ioni3Tudi+ (Če je medij vodni), da tvori kompleksni acuo [do (OH2)6]3+; ki je posledično hidroliziran, da zakisa okolje, torej AL3+ kisli ion:
Vam lahko služi: reakcija Cannizzaro: značilnosti, mehanizmi, primeriAl (OH)3(s) +3h3Tudi+(ac) => [al (oh2)6]3+(AC)
[Al (oh2)6]3+(Ac) +h2Ali (l) [al (oh2)5(OH)]2+(Ac)+h3Tudi+(AC)
Ko se to zgodi, se reče, da Al (OH)3 Obnaša se kot osnova, saj reagira s h3Tudi+. Po drugi strani pa lahko reagirate z OH-, obnaša se kot kislina:
Al (OH)3(s) +oh-(AC) => AH (OH)4-(AC)
V tej reakciji bela oborina AL (OH)3 Raztopi se na presežek ionov Oh-; Dejstvo, da se to ne zgodi enako z drugimi hidroksidi, kot so magnezij, mg (OH)2.
Al (OH)4-, Aluminatni ion, lahko se izrazi bolj kot: [Al (OH2)2(OH)4]-, poudarjanje koordinacijske številke 6 za kation3+ (Octaedro).
Ta ion lahko še naprej reagira z več OH- Do koordinacijskega oktahedra: [Al (OH)6]3-, imenovan heksahidroxoaluminat ion.
Nomenklatura
Ime 'aluminijev hidroksid', ki se je najbolj sklicevalo na to spojino. (Iii) je na koncu izpuščen, saj je status oksidacije aluminija +3 v vseh njegovih spojinah.
Drugi dve možni imeni, ki se nanašata na AL (OH)3 To so: aluminijev trihidroksid, glede na sistematično nomenklaturo in uporabo grških števcev; in aluminijev hidroksid, ki se konča s pripono -ico za eno samo oksidacijsko stanje.
Čeprav je na kemičnem polju nomenklatura AL (OH)3 Ne predstavlja nobenega izziva ali zmede, zunaj njega se ponavadi meša z dvoumnimi.
Na primer, Gibbsita Mineral je eden od naravnih polimorfov AL (OH)3, na katero tudi poimenujejo γ-al (OH)3 ali α-al (OH)3. Vendar α-al (OH)3 Prav tako lahko ustreza mineralu Bayerita ali β-al (OH)3, Glede na kristalografsko nomenklaturo. Medtem sta polimorfi Nordstrandita in Doyleita običajno označeni kot (OH)3.
Naslednji seznam jasno povzema novo razloženo:
-Gibbsita: (γ ali α) -Al (OH)3
-Bayerita: (α ali β) -Al (OH)3
-Nordstrandita: Al (OH)3
-Doyleita: AL (OH)3
Prijave
Surovina
Takojšnja uporaba za aluminijev hidroksid je kot surovina za proizvodnjo glinic ali drugih spojin, anorganskega ali organskega, aluminija; Na primer: alcl3, Z ne3)3, Alf3 ali naal (OH)4.
Katalitične nosilce
Al (OH) nanodelci3 Delujejo lahko kot katalitične nosilce; to pomeni, da se jim katalizator pridruži, da bi bili pritrjeni na svoji površini, kjer se pospešijo kemične reakcije.
Vam lahko služi: Sinteza reakcija: vrste, dejavniki, primeriMednarodne spojine
V razdelku strukture je bilo razloženo, da je AL (OH)3 Sestavljen je iz plasti ali listov A in B, skupaj za določitev kristala. Znotraj njega so majhni oktaedrski prostori ali vdolbinice, ki jih lahko zasedajo drugi ioni, kovinski ali organski ali nevtralni molekuli.
Ko se kristali sintetizirajo iz (OH)3 S temi strukturnimi spremembami se pravi, da se pripravlja spojina interkalacije; torej prepletene ali postavljene kemične vrste med listi A in B. Pri tem nastanejo novi materiali, izdelani iz tega hidroksida.
Ogenj retardant
Al (OH)3 To je dober požarni zaostanek, ki nanese kot polnjenje materiala številnih polimernih matric. To je zato, ker absorbira toploto, da sprosti vodno paro, kot to počne mg (OH)2 ali brucita.
Zdravilno
Al (OH)3 Je tudi nevtralizirajoča kislost, reagira s HCl želodčnih izločkov; Spet, podobno kot to, kako se zgodi z MG (OH)2 magnezijskega mleka.
Oba hidroksida lahko mešamo v različnih antacidih, ki se uporabljata za lajšanje simptomov ljudi, ki trpijo zaradi gastritisa ali želodčnih razjed.
Adsorbent
Ko se segreje pod njegovo tališče, se aluminijev hidroksid pretvori v aktivirano glinico (kot tudi aktivirano ogljik). Ta trdna snov se uporablja kot adsorbent nezaželenih molekul, bodisi barvil, nečistoč ali onesnaževalskih plinov.
Tveganja
Tveganja, ki lahko predstavljajo aluminijev hidroksid, niso posledica trdnih, ampak kot zdravilo. Za njegovo shranjevanje ni potreben protokol ali predpisi, saj ne reagira odločno z oksidacijskimi sredstvi in tudi ni vnetljiv.
Pri zaužitju v antacidih, ki jih dosežemo v lekarnah, se lahko pojavijo nezaželeni neželeni učinki, kot sta zaprtje in inhibicija črevesnega fosfata. Tudi in čeprav ni študij, ki bi to pokazale, je bila povezana z nevrološkimi motnjami, kot je Alzheimerjeva bolezen.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Aluminij hidroksida. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Aluminij hidroksida. Baza podatkov Pubchem. Cid = 10176082. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Danielle Reid. (2019). Aluminij hidroksida: formula in neželeni učinki. Študij. Okrevano od: študij.com
- Robert Schoen & Charles in. Roker. (1970). Strukture aluminijevega hidroksida in geokemičnih posledic. Ameriški mineralogist, vol 55.
- Vitaly p. ISUPOV & COL. (2000). Sinteza, struktura, lastnosti in uporaba aluminijevih hidroksidnih interkalacijskih spojin. Kemija za trajnostni razvoj 8,121-127.
- Droge. (24. marec 2019). Neželeni učinki aluminijaste hidrokside. Okrevano od: droge.com
- « Zgodovina Vanadio, lastnosti, struktura, uporabe
- Zgodovina niklja, lastnosti, struktura, uporabe, tveganja »

