Katalitična hidrogenacija
- 3477
- 366
- Don Nitzsche
 Katalitična hidrogenacija je kemična reakcija, kjer je končni rezultat dodajanje vodika v drugo spojino. Vir: Gabriel Bolívar
Katalitična hidrogenacija je kemična reakcija, kjer je končni rezultat dodajanje vodika v drugo spojino. Vir: Gabriel Bolívar Kaj je katalitična hidrogenacija?
The Katalitična hidrogenacija To je kemična reakcija, s katero se v spojini doda molekularni vodik z večjo hitrostjo.
H molekula2 Ne samo, da mora najprej prekiniti svojo kovalentno vez, ampak tudi tako majhne, učinkovite trke med njim in spojino do mesta, kjer se bo dodala.
Spojina vodikovega receptorja je lahko organska ali anorganska. V organskih spojinah so tam, kjer je največ primerov katalitične hidrogenacije, zlasti tistih, ki imajo farmakološko aktivnost ali imajo kovine vgrajene v svoje strukture (organometalne spojine).
Ko je h dodan2 Na strukturo, polno ogljika, se zgodi, da se njena nenasilnost zmanjšuje, to je, da ogljik doseže največjo stopnjo preprostih povezav, ki jih lahko tvori.
Zato h2 Dodane so dvojne (C = C) in Triple (C≡C) povezave, čeprav jih lahko dodate tudi v skupinah karbona (C = O).
Tako alkeni in alkini reagirajo s katalitično hidrogenacijo. Površinsko analizo katere koli strukture je mogoče predvideti, ali bo dodal ali ne2 Samo zaznajte dvojne in trojne povezave.
Značilnosti katalitične hidrogenacije
Slika prikazuje mehanizem te reakcije. Vendar je treba pred opisovanjem obravnavati nekatere teoretične vidike.
Površine sive sfere predstavljajo kovinske atome, ki so, kot bo razvidno, katalizatorji hidrogenacije par odličnosti.
Rupture vodikove vezi
- Hidrogenacija je eksotermična reakcija, to je, da sprošča toploto kot posledica tvorbe nižjih energijskih spojin.
Vam lahko služi: acetanila (c8h9no)- Oblikovane vezi C-H so stabilne, kar zahteva večjo energijo za kasnejše rupture kot H-H vez molekularne vodikove potrebe.
- Hidrogenacija vedno vključuje najprej rupturo povezave H-H. Ta ruptura je lahko homolitična, kot v mnogih primerih:
H-h => h ∙ + ∙ h
Ali heterolitik, ki jo lahko damo na primer, kadar je cinkov oksid vodik, ZnO:
H-h => h+ + H-
- Razlika med obema razpadama je v tem, kako se porazdelijo povezave elektrone. Če se razdelijo enako (kovalentno), vsak H konča zadrževanje elektrona, medtem ko je porazdelitev ionska, ena se konča brez elektronov, h+, In drugi jih v celoti osvoji, h-.
- Obe rupturi sta možni pri katalitični hidrogenaciji, čeprav homolitik omogoča pot do razvoja logičnega mehanizma za to.
Eksperimentalno
- Vodik je plin, zato mora biti mehurček in zagotavljanje, da prevladuje le na površini tekočine.
- Hidrogenarno spojino je treba solubilizirati v mediju, naj bo to voda, alkohol, eter, estri ali tekoči amin. V nasprotnem primeru bi hidrogenacija minila zelo počasi.
Raztopljeno spojino na hidrogenar, v reakcijskem mediju mora biti tudi katalizator. To bo odgovorno za pospešitev hitrosti reakcije.
- Pri katalitični hidrogenaciji se običajno uporabljajo fino razdeljene kovine niklja, paladija, platine ali rodija, ki so netopne v skoraj vseh organskih topilih. Zato bosta dve fazi: tekočina z raztopljeno spojino in vodik ter trdno snov, ki.
Lahko vam služi: križarjenje po lončku: značilnosti, funkcije, uporabite primere- Te kovine zagotavljajo svojo površino tako, da se vodik in spojina reagirata, tako da se prelomi vezi pospešijo.
- Prav tako zmanjšajo prostor za razširjanje vrste, kar poveča število učinkovitih molekulskih trkov. Ne samo to, ampak celo reakcija poteka znotraj pore kovine.
Vrste katalitične hidrogenacije
Homogeno
Govori o homogeni katalitični hidrogenaciji, ko je medij reakcije sestavljen iz ene faze. Tu je uporaba kovin v njihovih čistih državah, saj so netopne.
Namesto tega se uporabljajo organometalne spojine teh kovin, ki so topne in so dokazane, da imajo visoke donose.
Ena od teh organometalnih spojin je Wilkinson Catalyst: Tris klorid (trifenilfin) Rodio, [(C6H5)3P]3Rhcl.
Te spojine tvorijo kompleks s h2, Aktiviranje za svoj naslednji dodatek k alkene ali Alquino.
Homogena hidrogenacija predstavlja veliko več alternativ kot heterogene, ker je kemija v organometalnih spojinah obilna: dovolj je, da spremenite kovino (PT, PD, RH, NI) in ligande (organske ali anorganske molekule, povezane s kovinskim središča), do Pridobite novega katalizatorja.
Heterogena
Heterogena katalitična hidrogenacija, kot je rečeno, ima dve fazi: ena tekočina in ena trdna snov.
Poleg kovinskih katalizatorjev obstajajo tudi drugi, ki so sestavljeni iz trdne mešanice. Na primer, katalizator Lindlar, ki je sestavljen iz platine, kalcijevega karbonata, svinčevega acetata in kinolina.
Lindlar katalizator ima posebnost, da je slaba za hidrogeniranje alkenov. Vendar je zelo koristno za delne hidrogenacije, to je, da na alkinih odlično deluje:
Vam lahko služi: lutecio: struktura, lastnosti, uporabe, pridobivanjeRC≡CR + H2 => Rhc = crr
Mehanizem
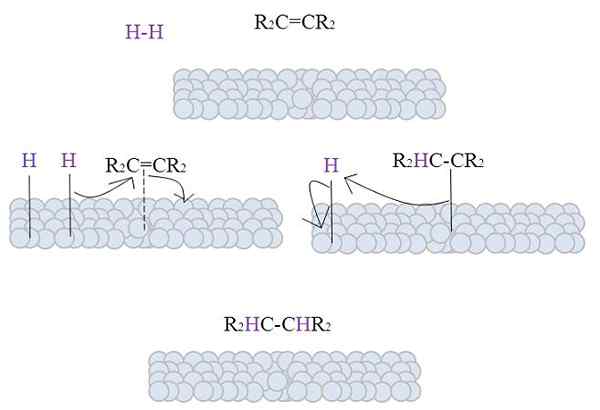
Slika prikazuje mehanizem katalitične hidrogenacije z uporabo kovine v prahu kot katalizatorju.
Sive kroglice ustrezajo kovinski površini, recimo, platina. Molekula h2 (vijolična barva) je blizu kovinske površine, pa tudi nadomestne tetra alkene, r2C = cr2.
H2 Interakcija z elektroni, ki potujejo po kovinskih atomih, se pojavi prelom in nastajanje H-M časovne povezave, kjer je m kovina. Ta postopek je znan kot Kemisorpcija. To pomeni adsorpcija kemičnih sil.
Alkene deluje na podoben način, vendar ga povezava tvori z dvojno vezjo (pikčasta črta).
H-H vez se je že ločila in vsak vodikov atom ostane povezan s kovino. Podobno je s kovinskimi centri v organometalnih katalizatorjih, ki tvorijo vmesni kompleks H-M-H.
Nato se pojavi selitev h proti dvojni vezi in to se odpira, kar tvori povezavo s kovino. Nato se preostali H pridruži drugemu ogljiku iz prvotne dvojne vezi, in proizvedeni alkani se končno sprosti, r2Hc-chr2.
Ta mehanizem se bo ponovil tolikokrat, dokler ne bo vse H2 so popolnoma reagirali.
Reference
- Carey, f. (2008). Organska kemija. MC Graw Hill.
- Shiver & Atkins (2008). Anorganska kemija. MC Graw Hill.
- Lew, J. (s.F.). Katalitična hidrogenizacija alkenov. Kem je okreval.Librettexts.org
- Kaj je katalitična hidrogenacija? - Mehanizem in reakcija. Študija je bila obnovljena.com

