Nenasičeni ogljikovodiki
- 4769
- 533
- Roman Schamberger
Pojasnjujemo, kakšni nenasičeni ogljikovodiki, njihovi klasifikaciji, lastnosti, nomenklaturi in dajejo več primerov
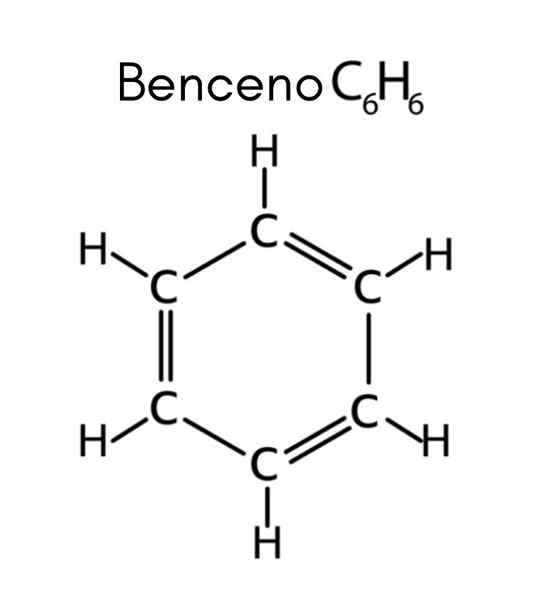
 Benzen je primer nenasičenega ogljikovodika
Benzen je primer nenasičenega ogljikovodika Kaj so nenasičeni ogljikovodiki?
The nenasičeni ogljikovodiki So organske spojine, ki jih tvorita samo ogljik in vodik, ki imajo eno ali več vezi med ogljikovimi atomi. To pomeni, da katera koli spojina formule CxHin ki predstavlja dvojno ali trojno vez je nenasičen ogljikovodik.
Nenasičene ogljikovodike tvorijo alkeni in alkini, pa tudi aromatične spojine. Razlog, zakaj so nenasičeni, je, ker imajo manjše število vodikov od največjega, kar bi lahko imeli, glede na število ogljikovih atomov v strukturi.
Nenasičene ogljikovodike se prepoznajo tako, da imajo manj kot 2N+2 vodiki (kar je največje število vodikov, ki so lahko ogljik), kjer je N število ogljikovih atomov v molekularni formuli.
Primer nenasičenega ogljikovodika je buteno, katerega molekularna formula je c4H8. Največje število vodikov za 4 ogljikove 2 (4) +2 = 10 vodiki. To ustreza številu vodikov nasičenega ogljikovodika. Ker ima buteno le 8 vodikov, kar je manj kot 10, potem je nenasičen ogljikovodik.
Število nenasičenosti
Za nenasičene ogljikovodike je značilno število nenasičenosti. To kaže, da se število vodikovih parov manj kot nenasičen ogljikovodik primerja z nasičenim, ki ima enako število ogljikov.
Število nenasičenosti se lahko izračuna za katero koli nenasičeno spojino z naslednjo formulo:
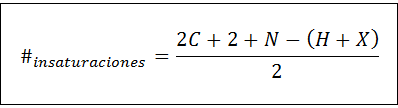
Kjer so C, N, H in X v molekularni formuli predstavljajo število ogljikovih, dušikov, vodičev in halogenov. Ta številka nam daje predstavo o tem, koliko dvojic ali trojnih vezi ima spojino glede na svojo molekularno formulo, čeprav je treba paziti, ker cikli (ki niso nenasičenost) prav tako prispevajo k številu nenasičenosti:

Primer
Benzen ima formulo c6H6, Torej je število nenasičenosti:
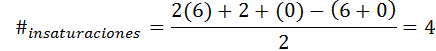
V tem primeru 4 nenasičenost ustreza trem dvojnim povezavam in ciklu.
Razvrstitev nenasičenih ogljikovodikov
Glede na vrsto ogljikovodika
- Alkeni: Oni so tisti, ki imajo v svoji strukturi vsaj eno dvojno povezavo.
- Alkynes: Oni so tisti, ki imajo v svoji strukturi vsaj eno trojno povezavo.
- Aromatično: So ciklične polinenasičene spojine s posebnimi lastnostmi, zaradi katerih so še posebej stabilne.
Glede na ogljikovo verigo
- Linearno: nenasičene spojine, v katerih so vsi atomi ogljika povezani med seboj v eni verigi.
- Ramificirano: So tisti, ki imajo glavno verigo in tudi več stranskih verig, ki tvorijo posledice.
- Ciklično: To so tisti, v katerih je predstavljen zaprt cikel ogljikovih atomov, v katerem je predstavljena vsaj ena dvojna ali trojna vez (cikloalkina, cikloalkinos in aromatični).
Glede na število nenasičenosti
- Mononasičeno: Kadar imajo samo večkratno povezavo, to je ena sama dvojna vez ali ena sama trojna povezava.
- Polinnasičeno: Kadar ima struktura več kot eno več povezave, kot v primeru alkijskih, alkijskih, alkeninov itd.
Lastnosti nenasičenih ogljikovodikov
Lastnosti nenasičenih ogljikovodikov močno so odvisne od posebne vrste ogljikovodika:
Fusion in vrelišča
Na splošno imajo nenasičeni ogljikovodiki nizke fuzije in vrelišča. Vendar imajo v primerjavi z alkani alkeni z enakim številom ogljika in podobno glavno verigo običajno nižjo vrelišče, medtem ko imajo Alkines večje vrelišča.
Enako velja za fuzijske točke. V naslednji tabeli je razvidno, da sta tako fuzijska točka kot vrelišče 1-pentena nižja od pentana kot tista, da tista 1-pentino.

Fizično stanje
Zaradi nizkih točk in vrelišča so nenasičeni ogljikovodiki z nizko molekulsko maso ponavadi plinasti pri sobni temperaturi. Številni so tudi tekoči in tisti z večjo molekulsko maso so trdne. V mnogih primerih so trdne snovi amorfne trdne snovi namesto kristalnih.
Polarnost
Vsi ogljikovodiki, vključno z nenasičenimi, so apolarne spojine, ker sta ogljikova elektronegativnost in vodik zelo podobna. Edina izjema je v primeru terminalnih alkinov2 in sp3.
Topnost
Ker so apolarni, nenasičeni ogljikovodiki so netopni v vodi in drugih polarnih topilih, vendar so zelo topni v apolarnih topilih, kot so ogljikov tetraklorid, cikloheksan in drugi. Pravzaprav so številne od teh spojin samo po sebi apolarna topila.
Lahko vam služi: disposio: struktura, lastnosti, pridobivanje, uporabeSo goriva
Značilnost vseh ogljikovodikov, vključno z nenasičenimi, je, da gorijo v prisotnosti kisika, da postanejo ogljikov dioksid in energijo sproščanja vode v obliki svetlobe in toplote.
Lahko polimerizirajo
Z različnimi kemičnimi reakcijami se lahko alkeni in alkini med seboj pridružijo, da tvorijo polimere, kot v primeru polietilena in polipropilena, če omenjam le nekatere. Tako nenasičeni ogljikovodiki so začetni material številnih skupnih plastikov.
Kemična reaktivnost
Reaktivnost je močno odvisna od vrste funkcionalne skupine, ki ima molekulo. V primeru alkenov in alkinov so običajno precej reaktivni in lahko trpijo reakcije hidrogenacije, hidracije, hidrohalogenacije in drugih vrst dodajanja reakcij.
Po drugi strani so aromatične spojine običajno precej inertne, ker so zelo stabilne. Karakteristične reakcije teh spojin so aromatične elektrofilne nadomestne reakcije.
Nomenklatura nenasičenih ogljikovodikov
Nomenklatura alkenov
Linearni alkeni
Ime linearnih alkenov je zgrajeno z namestitvijo predpone, ki označuje število ogljikovih atomov v verigi, sledi lokator ogljika, kjer se ločena dvojna vez začne s skriptami iz preostalega imena in zaključena s pripono _eno:
Prefix-Localizer
- Primer:
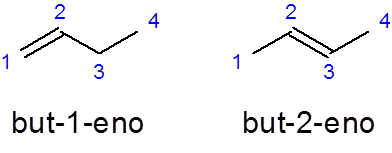
On Toda -1 -No To je ime linearne butene z dvojno vezjo v prvem ogljiku, medtem ko Vendar-2-dene Ima dvojno vez v drugem ogljiku.
Razvejani alkeni
V primeru razvejanih alkenov je najprej izbran najdaljša glavna veriga, ki vsebuje oba ogljika z dvojnim vezanjem in je prednostna naloga dvojne vezi oštevilčena. Ime je najprej zgrajeno tako, da postavimo posledice v abecednem vrstnem redu, pred katerimi so njegovi lokatorji, ki jim sledi ime glavne verige, kot je navedeno zgoraj.
- Primer:
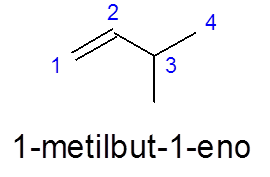
V 3-metilbut-1 -Enu se oštevilčenje opravi od leve proti desni, da daje prednost dvojni vezi, namesto da bi dali prednost razvejanju (metilna skupina).
Polieni
V primeru polinenasičenih ali polienoznih alkenov, ki vsebujejo več kot eno dvojno vez, je največje možno število dvojnih vezi izbran kot glavna veriga, ne glede na to, ali obstajajo druge daljše verige.
V imenu glavne verige je dodan lokator za vsako dvojno vez in predpono di, tri, tetra itd. Pred odpovedjo -Eno, da navedete število dvojnih povezav.
- Primer:
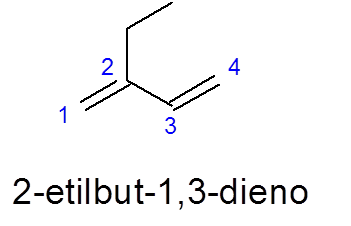
V tem primeru upoštevajte, da kljub dejstvu, da je več daljša veriga 5 ogljika, je 4 od 4 izbranih, saj vsebuje dve dvojni povezavi.
Nomenklatura Alkinosa
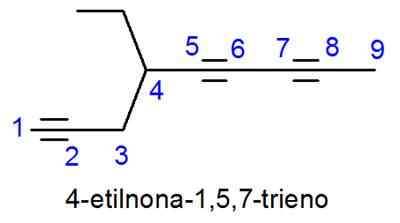
Alkini so poimenovani zelo podobni Alkeni, edina razlika pa se ime konča v -ino namesto -no. V primerih, ko je več kot ena trojna povezava, so nameščeni lokatorji in numerična predpona, ki označuje, koliko jih je.
- Primer:
Nomenklatura aromatičnih spojin
Aromatični ogljikovodiki so imenovani kot benzenski derivati in tako oštevilčenje kot način njihovega poimenovanja je odvisno od tega, koliko substituentov ima prstan.
Aromatični obroči z enim substituentom
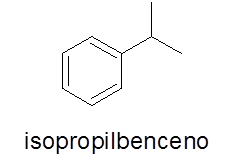
V tem primeru ni potrebno. Ime je sestavljeno iz imena veje, ki mu sledi beseda benzene.
- Primer:
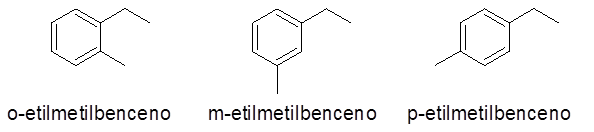
Aromatični obroči z dvema substituentama
V tem primeru je mogoče dati 3 številke ali nadomestne vzorce (1.2), (1.3) in (1,4). Kot je ravnodušno navesti, kateri nadomestek je v ogljiku 1 in katere v drugem, Ortho predpone (O-), meta- (m-) in para- (p-).
- Primeri:
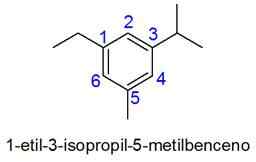
Aromatični obroči z več kot 2 substituentom
V tem primeru je izbrano oštevilčenje najmanjše kombinacije lokatorjev. Če sta dve številki enaki, je prednostna naloga substituentom v skladu z abecednim redom.
- Primeri:
Primeri nenasičenih ogljikovodikov
Nato so predstavljeni dodatni primeri nenasičenih ogljikovodikov.
Acetilen (c2H2)
Acetilen je skupno ime Etino, najpreprostejše alkemine. Ta spojina ima 2 nenasičenost zaradi svoje trojne povezave in se med drugim uporablja v jekleni in varilni opremi.
Cikloheksen (c6H10)
6 -ogljikov ciklični alken, ki ima dva nenasičenost: enega zaradi cikla in drugega zaradi dvojne vezi.
Raztezanje (c8H8)
Ta spojina se običajno uporablja pri pripravi polimerov. Je aromatičen alken s 5 nenasičenostjo.

