Kemična hibridizacija

- 3437
- 833
- Ricky Dach
Kaj je kemična hibridizacija?
The Kemična hibridizacija To je "mešanica" atomskih orbitalov, katerih koncept je leta 1931 uvedel kemik Linus Pauling, da bi zajel nepopolnosti Valencijeve teorije povezav (TEV). Katere nepopolnosti? To so: molekularne geometrije in enakovredne povezave v molekulah, kot je metan (ch4).
Po TEV v metanu atomske orbitale C tvorijo štiri σ povezave s štirimi a atomi. Orbitale 2p z oblikami ∞ (spodnja slika) C so med seboj pravokotne, zato je treba H odstraniti drug od drugega pod kotom 90 °.

Poleg tega 2S (sferična) orbitala. Vendar je bilo eksperimentalno ugotovljeno, da so koti v CH4 So 109,5 ° in to so poleg tega dolžine povezav C-H enakovredne.
Če želite to razložiti, je treba upoštevati kombinacijo originalnih atomskih orbitalov, ki tvorijo štiri degenerirane hibridne orbitale (enake energije). Tu se začne igrati kemična hibridizacija. Kako so hibridne orbitale? Odvisno je od atomskih orbital, ki jih ustvarjajo. Imajo tudi mešanico teh elektronskih značilnosti teh.
Sp3
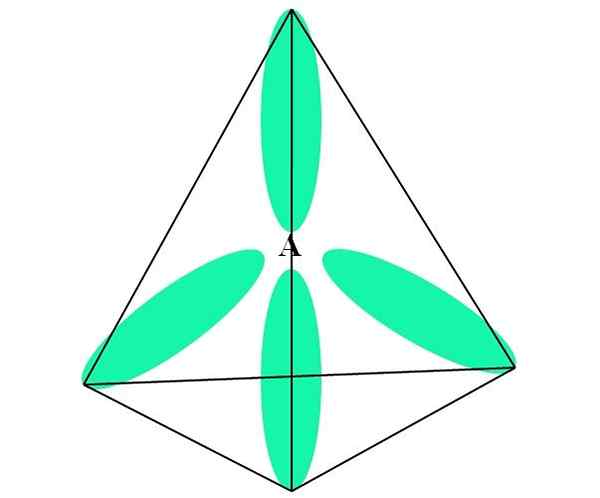
V primeru ch4, C hibridizacija je sp3. Iz tega pristopa je molekularna geometrija razložena s štirimi SP orbitali3 ločeno pri 109,5 ° in kazanje proti točki tetraedrona.
Na zgornji sliki lahko vidite, kako orbitale sp3 (zelena) Vzpostavite tetraedrsko elektronsko okolje okoli atoma (a, ki je c za ch4).
Vam lahko služi: amineZakaj 109,5 ° in ne drugih kotov, da bi "narisali" drugačno geometrijo? Razlog je posledica dejstva, da ta kot minimizira elektronske odbojnosti štirih atomov, ki so povezani.
Na ta način je molekula Cho4 Lahko ga predstavljamo kot tetraedro (tetraedrska molekularna geometrija).
Če namesto H namesto H tvori povezave z drugimi skupinami atomov, kakšna bi bila njegova hibridizacija? Pod pogojem, da ogljik tvori štiri povezave σ (C-A), bo njegova hibridizacija SP3.
Dosledno je mogoče domnevati, da v drugih organskih spojinah, kot je ch3Oh, ccl4, C (pogl3)4, C6H12 (ciklohekan) itd., Carbon ima hibridizacijo SP3.
To je bistvenega pomena za skiciranje organskih struktur, kjer ogljikovi s preprostimi povezavami predstavljajo razhajajoče se točke; to pomeni, da struktura ne ostane v eni ravnini.
Interpretacija
Kaj je najpreprostejša razlaga za te hibridne orbitale, ne da bi se lotili matematičnih vidikov (valovne funkcije)? Orbitale sp3 Nakazujejo, da so izvirale štiri orbitale: ena s in tri P.
Ker naj bi bila kombinacija teh atomskih orbitalov idealna, štiri SP orbitale3 Rezultat so enake in zasedajo različne usmeritve v vesolju (na primer v orbitalih Px, strin In pz).
Zgoraj je uporabno za preostale možne hibridacije: število nastalih hibridnih orbitalov je enako kot pri atomskih orbitalih, ki se združujejo. Na primer, sp híbridos orbital3d2 Nastajajo iz šestih atomskih orbital: ena S, tri P in dva D.
Odstopanja od kotov povezave
V skladu s teorijo odbojnosti elektronskih parov plasti Valencije (RPECV) par prostih elektronov zaseda več volumna kot povezan atom. To povzroči, da se povezave oddaljujejo, zmanjšajo elektronsko napetost in preusmerijo kote 109,5 °:
Lahko vam služi: križarjenje po lončku: značilnosti, funkcije, uporabite primere
Na primer, v molekuli vode so atomi H povezani z orbitali sp3 (v zeleni barvi) in tudi pari elektronov, ki se ne delijo ":" Zasedejo te orbitale.
Odbojnosti teh elektronskih parov so običajno predstavljene kot "dva balona z očmi", ki zaradi njihove glasnosti odvrnejo obe povezavi σ o-h.
Tako so v vodi koti vezi res 105 °, namesto 109,5 ° pričakovane za tetraedrsko geometrijo.
Kaj ima geometrija h2Tudi? Ima kotno geometrijo. Ker? Ker je elektronska geometrija tetraedrska.
Sp2
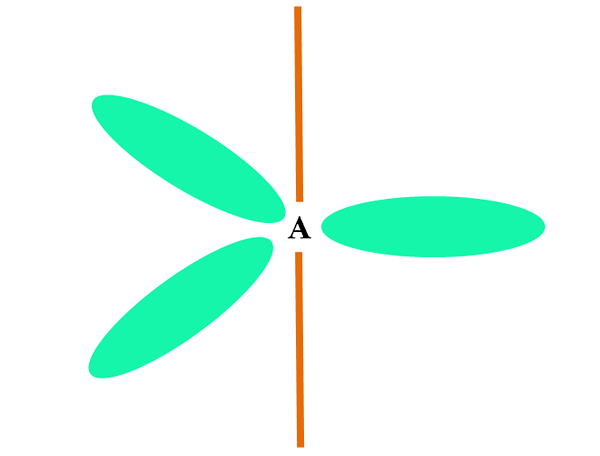
Ko atom združuje dve ali s orbitali, ustvari tri hibridne orbitale sp2; Vendar orbitalni p (ker so trije) ostane nespremenjen, ki je predstavljen kot oranžna palica.
Tu so tri orbitale sp2 So zeleni, da poudarijo svojo razliko od oranžne palice: orbitalni p "čist".
Atom s hibridizacijo SP2 Lahko ga vizualiziramo kot trigonalno ravno nadstropje (trikotnik, narisan s SP orbitali2 zelena), s svojimi vrhovi, ločenimi z 120 ° koti in pravokotno na palico.
In kakšno vlogo ima orbitalna čista igra? Za oblikovanje dvojne vezi (=). Orbitale sp2 Omogočajo tvorbo treh povezav σ, medtem ko orbitalna čista p vez π (dvojna ali trojna povezava vključuje eno ali dve povezavi π).
Na primer, da narišemo karbonilno skupino in strukturo molekule formaldehida (H2C = o), nadaljuje na naslednji način:
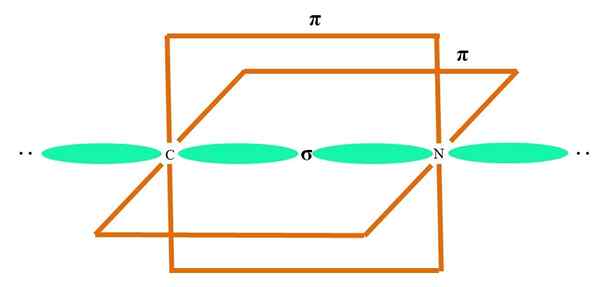
Lahko vam služi: cikopropan (C3H6)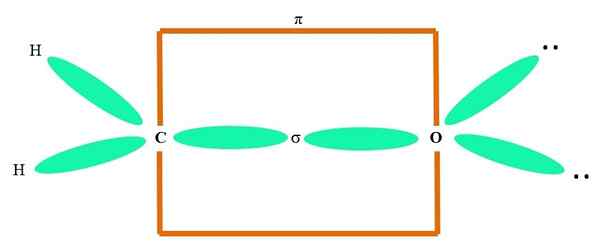
Orbitale sp2 Tako C kot O tvorita povezavo σ, medtem ko njene čiste orbitale tvorijo π vez (oranžni pravokotnik).
Opazimo, kako so preostale elektronske skupine (H atomi in pari ne skupnih elektronov) nameščeni v drugih orbitalih SP2, ločeno z 120 °.
Sp
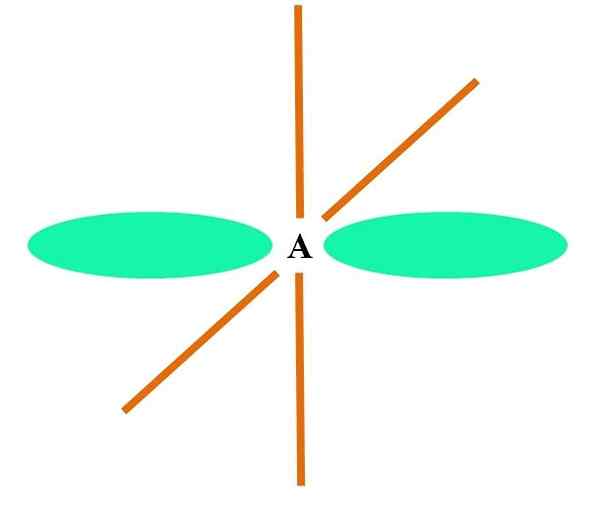
Na vrhunski sliki je atom ponazorjen s hibridizacijo SP. Tukaj, orbitalni s in orbitalni p. Vendar sta dve čisti orbitalni orbitali zdaj nespremenjeni, ki jim omogočata, da tvorita dve dvojni povezavi ali trojna povezava (≡).
Z drugimi besedami: Če v strukturi A C izpolnjuje zgornje (= c = o c≡C), potem je njegova hibridizacija SP. Za druge manj ilustrativne atome - kot so prehodne kovine - je opis elektronskih in molekulskih geometrij zapleten, ker se upoštevajo tudi orbitale D in celo F.
Hibridne orbitale so ločene pod kotom 180 °. Zaradi tega so povezani atomi razporejeni v linearno molekularno geometrijo (B-A-B). Končno je na spodnji sliki videti strukturo aniona cianida: