Značilnosti hemoolosa, vrste, mehanizmi delovanja
- 1311
- 169
- Barry Ernser
The Hemoolozin Gre za majhen protein, ki povzroča pore v celični membrani eritrocitov in nekaterih drugih celic krvi sesalcev. Na splošno ga sintetizirajo in izločajo patogene bakterije.
Ta protein je eden najpogostejših mikrobnih toksinov in tisti, ki so ga najbolje preučili. Včasih lahko povzroči hemolitično anemijo, saj lahko količina kanalov, skozi katere izhaja notranjost celice, celo povzroči lizo celic.
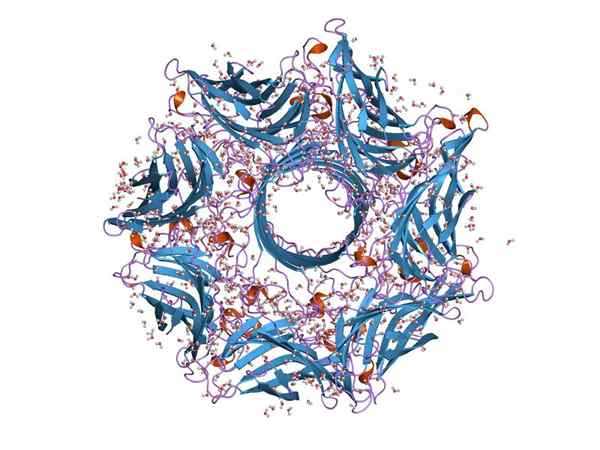
 Molekularna struktura hemoolozina (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [javna domena] prek Wikimedia Commons)
Molekularna struktura hemoolozina (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [javna domena] prek Wikimedia Commons) Na splošno je hemoolozin tipičen toksin vrste Streptococcus črevesnega trakta. Njegova funkcija omogoča bakterijam, da razbijejo epitelijsko pregrado črevesnega trakta in se tako premikajo skozi krvni obtok, da kolonizirajo druga tkiva.
Najpogostejši način, kako se v naravi najdemo hemoolozin, je v njeni α-hemolizinski obliki. Ta protein je eden najpomembnejših dejavnikov virulence večine sevov Escherichia coli in nekaj clostridov.
Večino okužb sečil so posledica sevov Escherichia coli ki proizvajajo α-hemolizin s hemolitičnimi lastnostmi.
Proizvodnja hemoolozina in bakteriocina je bila povezana z bakterijskimi sevi z mehanizmom kompetenc proti drugim vrstam, proizvodnja obeh toksinov.
[TOC]
Značilnosti
Hemoolozin sestavlja sedem podenot in gen, ki kodira sedem promotorjev. Teh sedem podenot je vstavljenih v plazemsko membrano belih celic in, ko skupaj tvorijo ionski kanal, kjer presnovki celične notranjosti pobegnejo.
Hemoolozin je zunajcelični citotoksin, odvisen od kalcija (Ca+2), ki deluje na plazemsko membrano krvnih torenskih celic. Pore, ki ustvarjajo v membrani, so tudi hidrofilne in povzročajo vstop vode v notranjost celice, kar lahko povzroči lizo.
Lahko vam služi: Unaporto: Prevoz skozi membrane, značilnostiHemoolozini so proteinski produkti, značilni za gram-negativne bakterije in vsi imajo dve značilnosti:
1- Prisotnost zelo majhnega peptida (nonapéptida), ki ga tvori ponavljajoči se glicin in asparaginska kislina. Hemoolozin nonapapéptidi se nahajajo v bližini C-terminalnega dela primarne beljakovinske strukture.
2- Vse hemoolozine izloča bakterija do zunajceličnega medija prek transporterja tipa ABC (iz angleške kasete za vezavo ATP).
Hemoolozine običajno odkrijemo v bakterijskih sevih z rastjo sredi krvnega agarja. V testu opazimo hemolitični halo, ki je produkt rupture rdečih krvnih celic v bližini kolonij bakterij.
Fantje
Obstaja več različnih vrst hemoolizinov, te so razvrščene z grškim pismom na začetku njihovega imena. Najbolj preučeni in pogosti so α, β in γ hemoolizini, ki jih proizvaja sev zlati stafilokok.
Tipi hemoolozinov so razvrščeni glede na obseg celic, ki napadajo in glede na njihovo primarno strukturo beljakovin.
α-hemolizin
Ta protein je značilen za seve zlati stafilokok in Escherichia coli; Napadi nevtrofilce, rdeče krvne celice, limfocite, makrofage, odrasle in embrionalne fibroblaste. Interakcijo s polarnimi glavami plazemskih membranskih lipidov teh celic, dokler ne ponotranji hidrofobnega repa približno 5 ӑ znotraj membrane.
β-hemolizin
Proizvaja zlati stafilokok V manjši delež kot α-hemolizin β-hemolizin v glavnem napade eritrocite in je v membrani notranji skozi bogata domena v sfingomielinu celične membrane.
γ-hemolizin
Opazili so ga tudi v zlati stafilokok. Hkrati je bil razvrščen kot hemolitični protein in levkotoksin, saj vpliva na polimorfonuklearne celice ljudi, monocitov, makrofagov in redko, celo na rdeče krvne celice.
Ta vrsta γ-hemolizina je ena najmanj značilnih, zato je večina njegovega mehanizma delovanja neznana in tega ni bilo raziskano In vivo.
Vam lahko služi: osteoblasti: usposabljanje, značilnosti, funkcije, patologijeMehanizmi akcije
Mehanizem delovanja, ki je bil razjasnjen, je razmeroma jasen, je α-hemolizin. Ker pa so vsi hemolitični proteini, se misli, da je večina procesov pogosta za vse hemolizine.
Znanstveniki predlagajo, da za bakterije ločijo hemoolozin na okolje, ki ga morajo biti v mikrookolju hranilne snovi, zato bi bil to mehanizem, ki sproži celico, da uniči bele celice in pridobi njihova hranila.
Mehanizem je bil opisan v treh korakih: Zveza do celične membrane, vstavitve in oligomerizacije.
Membranska zveza
Ugotovljeno je bilo, da se hemoolozini lahko pridružijo integrinom nevtrofilcev, pri eritrocitih.
Nekateri avtorji predlagajo, da prisotnost receptorjev v membrani ni bistvena za zvezo hemolizinov. V vsakem primeru mehanizem ponovnega koncemiranja celičnega proteina še ni natančno znan.
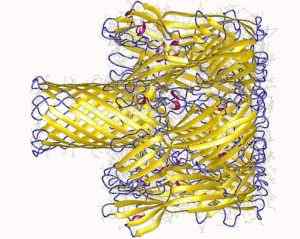 Transmembranalni pore, ki jih tvori protein s hemoolokom Staphylococcus (vir: Avtorji odlaganja: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., GOUAUX, J.In.; Avtor vizualizacije: Uporabnik: Astrojan [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] prek Wikimedia Commons)
Transmembranalni pore, ki jih tvori protein s hemoolokom Staphylococcus (vir: Avtorji odlaganja: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., GOUAUX, J.In.; Avtor vizualizacije: Uporabnik: Astrojan [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] prek Wikimedia Commons) Interakcija z membrano se pojavi v dveh korakih:
- Začetna zveza (reverzibilna): Ko se hemoolozin veže na domene membranskega kalcijevega stika. Ta korak se zgodi na površini in je zelo dovzeten za elektrostatične izpuste.
- Nepovratna zveza: rezervirajte domene aminokislin z lipidnimi sestavinami zunanje plasti plazemske membrane belih celic, da bi tvorili fizične sindikate med hidrofobnimi spojinami membrane.
Vam lahko služi: celična stenaVstavljanje toksina v membrano
Α-hemolizin vstavi odpadke 177 in 411 v prvi lipidni enoplast. V zunajceličnem mediju je hemoolozin povezan s kalcijevimi ioni, ki pri tem povzročajo strukturno razporeditev in prispevajo k njeni aktivaciji.
Ta vstavljanje konsolidira nepopravljivo zvezo v celično membrano. Ko se urediva zgodi, hemoolozin postane integralni protein, saj se eksperimentalno pokaže, da je edini način, da ga izvlečemo iz membrane, z uporabo detergentov, kot je Triton X-100.
Oligomerizacija
Ko je bil ves hemoolozin vstavljen v plazemsko membrano bele celice.
Opazili so, da so proces oligomerizacije naklonjeni mikrodominiji ali lipidni balzami celične membrane. Te regije morda ne bodo naklonjene zvezi beljakovin, ampak so naklonjene oligomerizaciji nje.
Bolj ko se hemoolonizini vežejo na membrano, večja bo količina pore. Poleg tega se lahko hemoolizini oligomerizirajo med seboj (sosednji) in tvorijo veliko večje kanale.
Reference
- Bakás, l., Ostolaza, h., Vaz, w. L., & Goñi, f. M. (devetnajst devetdeset šest). Reverzibilna adsorpcija in nepreveden vstavitev alfa-hemolizina Escherichia coli v lipidne dvosloje. Biophysical Journal, 71 (4), 1869-1876.
- Dalla Serra, m., Coraiola, m., Viero, g., Comai, m., Potrich, c., Ferreras, m.,… & Prévot, g. (2005). Staphylococcus aureus bicomponent γ-hemolizini, HLGA, HLGB in HLGC se lahko mešajo za štetje vseh komponent. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, j. Do., & Robinson, J. (1969). Lastnosti prečiščenega stafilokoknega β-hemolizina. Časopis za bakteriologijo, 97 (3), 1026-1032.
- Ike in., Hashimoto, h., & Clewell, D. B. (1984). Hemolizin Streptococcus faecalis subpecies zimogene prispevate k virulenci pri miših. Okužba in imunost, 45 (2), 528-530.
- Remington, J. S., Klein, j. Tudi., Wilson, c. B., Nizet, v., & Maldonado in. Do. (Eds.). (1976). Nalezljive puščave ploda in novorojenega dojenčka (Vol. 4). Philadelphia: Saunders.
- Todd, e. W. (1932). Antigeni streptokokni hemolizin. Journal of Experimental Medicine, 55 (2), 267-280.
- « Pietrain izvor, značilnosti, hrana, razmnoževanje
- Značilne značilnosti ventilov, histologija, funkcije »

