Globinske značilnosti, struktura, funkcija in spremembe
- 1245
- 320
- Ricky Dach
The globin To je struktura beljakovinske narave, razporejene v sferični ali kroglični obliki, od koder izvira njegovo ime. Ta struktura je terciarnega tipa in je značilna, da je kompleksna, saj se veriga aminokislin zloži tako, da tvorijo sferoprotein. Obstaja več vrst globinskih verig in te so bile razvrščene z grškimi črkami: Alfa, Beta, Delta, Gamma, Epsilon in Zeta.
Aminokisline, ki sestavljajo primarno strukturo beljakovin, se razlikujejo glede na vrsto, ki ji pripadajo (ljudje ali živali). Obstajajo tudi različice znotraj istih vrst glede na trenutno življenje organizma (embrionalno življenje, življenje ploda ali po rojstvu).
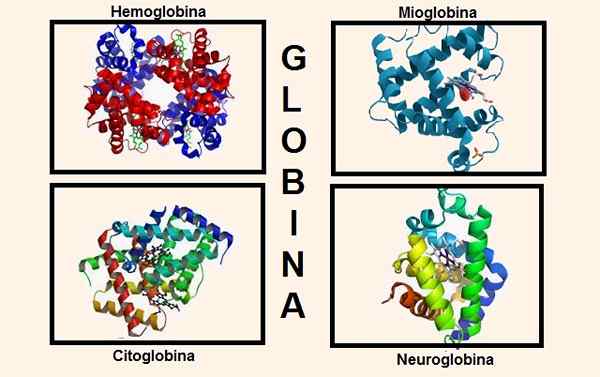
 Različne strukture, ki vsebujejo globin v svoji sestavi. Viri: Wikipedia.com/biancadescals [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]/originalni nalagalnik je bil proteinboxbot pri angleški Wikipediji. [Javna domena]/Wikipedia.com
Različne strukture, ki vsebujejo globin v svoji sestavi. Viri: Wikipedia.com/biancadescals [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]/originalni nalagalnik je bil proteinboxbot pri angleški Wikipediji. [Javna domena]/Wikipedia.com Genetske informacije za sintezo različnih verig Globin so vsebovane v različnih kromosomih. Na primer, alfa verižne globine najdemo na kromosomu 16, medtem ko so genetski podatki beta, delta, gama in epsilon na kromosomu 11.
[TOC]
Značilnosti
Globin je del pomembnih struktur v telesu, na primer najpomembnejše sta: hemoglobin in mioglobin.
Hemoglobin vsebuje štiri globinske verige (Alfa 1 in Alfa 2) in (beta 1 in beta 2). Vsak globin ima podvajanje, kjer ščiti hemo skupino.
Po drugi strani pa je mioglobin. Ki ima manj zapleteno strukturo kot hemoglobin. To predstavlja enkratni kroglični polipeptid, razporejen sekundarno.
Do nedavnega je bilo verjelo, da so to edine snovi, ki vsebujejo globin v višjih bitjih, danes pa sta znana še dva, ki imata globin v svoji ustavi: citoglobin in nevroglobin.
Citoglobin je prisoten v večini tkiv in je še posebej nameščen v vezivnem tkivu, prav tako pa je bil najden v mrežnici.
Nevroglobin ima prednost pred živčnim tkivom, od tod tudi njegovo ime. Nevroglobin so našli v možganskih živčnih celicah, ki se nahajajo na ravni cerebralne skorje, pa tudi na drugih lokacijah, kot so talamus, hipotalamus, hipokampus in možganski.
Vam lahko služi: Linnean taksonomija živih bitijVendar pa niso edine lokacije, saj je zunaj živčnega sistema, ki ga najdemo v Langerhansovih otočkih trebušne slinavke in v mrežnici.
Struktura
Obstaja 6 različnih vrst globinskih verig, ki so označene s črkami grške abecede: alfa (α), beta (β), gama (γ), delta (Δ), Epsilon (ε) in Zeta (ζ). Te verige pripadajo družini globusov, vendar se med seboj razlikujejo po številu aminokislin, ki jih imajo.
Ti polipeptidi imajo primarno, sekundarno in terciarno strukturo. Preprosta veriga aminokislin predstavlja primarno strukturo. Ko se veriga valja z oblikovanjem spirale ali propelerjev, sestavljajo sekundarno strukturo.
Če se ta struktura večkrat zloži na sebi, tvori kroglasto strukturo, ki ustreza terciarni strukturi.
Prav tako lahko pridobijo kvartarno obliko le, če se 4 molekule ali globinske verige združijo v terciarni obliki.
To je predstavljeno v zapleteni strukturi hemoglobina. Vendar je v mioglobinu drugače. V tem primeru je globin predstavljen kot monomer, torej ima eno samo peptidno verigo, ki je razporejena v pregibih, ki ustvarja 8 propelerjev (sekundarna struktura).
Tako hemoglobin kot mioglobin hiši hemo skupino znotraj njihove zapletene strukture.
Hemoglobin
V tej molekuli sta združeni 2 alfa globinski verigi in 2 beta verigi. Tako so popolnoma povezani s skupino Hemo v njenem središču in železom.
Med temi strukturami so šibki in močni sindikati. V šibkih sindikatih sodeluje 19 aminokislin, zveza pa se pojavi na naslednji način: veriga Alfa 1 se pridruži verigi Beta 2, veriga Alfa 2 pa se pridruži beta verigi 1.
Medtem ko je 35 aminokislin in verig, ki se pridružijo,: veriga Alfa 1 se pridruži verigi Beta 1, veriga Alfa 2.
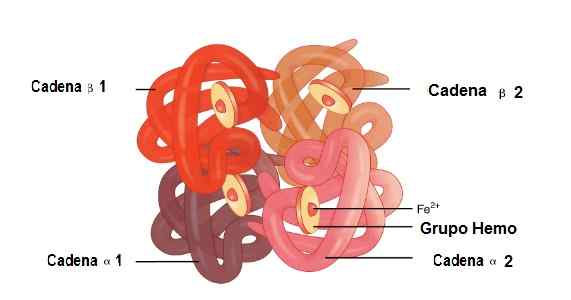 Lokacija verig Alfa 1 in Alfa 2, Beta 1 in Beta 2 v strukturi hemoglobina. Vir: OpenX College [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] urejena slika (prevedena v španščino)
Lokacija verig Alfa 1 in Alfa 2, Beta 1 in Beta 2 v strukturi hemoglobina. Vir: OpenX College [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] urejena slika (prevedena v španščino) Mioglobin
V mioglobinu je prisotna tudi globularna beljakovinska skupina, v tem primeru pa je ena sama peptidna veriga, sestavljena iz 153 aminokislin. Njegova prostorska razporeditev je sekundarna in predstavlja 8 alfa propelerjev.
Lahko vam služi: oligoces: za kaj so, za kaj so in kaj soTa beljakovinska struktura strateško postavlja hidrofobne aminokisline v strukturo, hidrofilne ali polarne aminokisline.
Ta zasnova je kot nalašč za nastanitev skupine hemo v notranjosti (hidrofobni del). To se veže na beljakovine z ne -kovalentnimi vezmi.
Citoglobin
Odkrili so ga leta 2001 in pravi se, da gre za vrsto hemoglobina, vendar se razlikuje po tem, da je heksakoordiniran, medtem ko sta hemoglobin in mioglobin pentakoordinata. To je povezano s položajem, ki ga je sprejela aminokislina histidin blizu skupine hemo.
Nevroglobin
Njegovo odkritje je bilo narejeno leta 2000. Neuroglobin je monomer, ki ima 150 aminokislin, zato je zelo podoben mioglobinu. Struktura nevroglobina ima podobnost med 21 in 25% z mioglobinom in hemoglobinom.
Funkcije
Ker Globin ni sam v telesu, ampak ker je del nekaterih struktur, so omenjene funkcije, ki jih izpolnjuje vsak od njih:
Hemoglobin
Nahaja se znotraj eritrocitov. Odgovoren je za pritrditev in prevoz kisika iz pljuč do tkiv. Kot tudi telo ogljikovega dioksida, ki naredi nasprotno pot.
Mioglobin
Skupina hemo, ki se nahaja v GlobInu.
Citoglobin
Verjame se, da ta protein vpliva na zaščito hipoksije in oksidativnih stresnih stanj v tkivih. Prav tako se misli, da lahko arterijski kisik prevaža v možgane.
Nevroglobin
Menijo, da ima nevroglobin sposobnost pritrditve kisika, monoksida ogljikov in dušikov oksid.
Vendar še ni znano z gotovostjo, kakšna je funkcija nevroglobina, vendar se verjame, da je povezan z regulacijo hipoksije in cerebralne ishemije. Še posebej bi deloval kot nevroprotektor.
Vam lahko služi: teorija transformizma LamarckKer ima nevroglobin strukturo, podobno hemoglobinu in mioglobinu, ugiba, da bi lahko sodeloval pri oskrbi s kisikom na ravni nevronov. Verjame se tudi, da lahko odpravi proste radikale in dušik, ki se pojavijo v dihalni verigi.
Glede na dušikov oksid naj bi ga odpravili, ko je kisik normalen, in ga proizvaja v hipoksiji2.
Spremembe
Alpha in beta verige Globin so kodirani z različnimi geni, ki se nahajajo na kromosomih 16 oziroma 11.
Posamezniki, ki imajo hemoglobin (falciform ali Drapanacitna anemija), imajo napako v beta verigi globina. Napaka je sestavljena iz nadomestitve dušikovih baz na ravni nukleotidne številke 20 vpletenega gena, kjer se s timinom spremeni adenin.
Mutacije v β genus kromosoma 11 izvira iz različnih halopov Globine, imenovanih: Senegal, Kamerun, Benín, Bantú ali Car ter Azijsko ali arabsko-Indian.
Poznavanje vrste haplotipa, ki so ga predstavljali bolniki z falciformno anemijo.
Na primer: znano je, da je halotip Bantu resnejši, medtem ko sta senegal in azijski tip blažji.
Razlike med haplotipom in drugim ležijo v količini hemoglobina f, ki jo imajo. Večji odstotek hemoglobina F in spodnjega hemoglobina je boljša prognoza. Manj hemoglobina F in več hemoglobina S slabše napovedi.
Te mutacije so samodejno podedovane skupaj z mutacijo hemoglobina s.
Reference
- "Globin." Wikipedia, brezplačna enciklopedija. 19. oktober 2018, 13:44 UTC. 11. julij 2019, 17:26, Wikipedia.org
- »Mioglobin." Wikipedia, brezplačna enciklopedija. 7. julij 2019, 21:16 UTC. 11. julij 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Halotipi gena beta globin v nosilcih hemoglobina v Kolumbiji. Biomedical 2012; 32: 103-111. Na voljo na: Scielo.org
- Forrellat M, Hernández P. Neuroglobin: nov član družine Glinas. Kubanski rev imunol hemother 2011; 27 (3): 291-296. Na voljo na: Scielo.Sld
- "Citoglobin." Wikipedia, brezplačna enciklopedija. 1. septembra 2017, 17:26 UTC. 12. julij 2019, 00:28 Wikipedia.org
- « Značilnosti, struktura, funkcije heteropolisaharidi
- Paranoidni simptomi, vzroki in zdravljenje shizofrenije »

