Van der Waals sile
- 1052
- 12
- Ms. Pablo Lebsack
Pojasnjujemo, kaj so van der Waals sile, njihove značilnosti, vrste in dajejo primere v vsakem
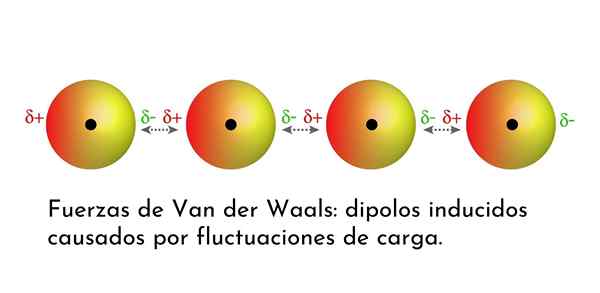
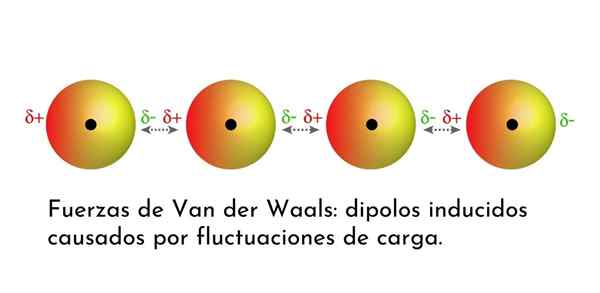 Ilustracija, ki prikazuje eno od vrst sil Van der Waalsa, londonske disperzijske sile, med več atomi s takojšnjim dipolom
Ilustracija, ki prikazuje eno od vrst sil Van der Waalsa, londonske disperzijske sile, med več atomi s takojšnjim dipolom Kaj so sile Van Der Waalsa?
The Van der Waals sile So niz privlačnih sil kratkih barv med vsemi atomi in molekulami. Svoje ime prejmejo v čast nizozemskega znanstvenika Johannesa Diderika van der Waalsa.
Te sile so razmeroma šibke, vendar se pojavljajo na celotni kontaktni površini med dvema atomama, med dvema molekulama ali med dvema površinama, tako da, če je omenjena kontaktna površina velika, lahko sile van der Waalsa postanejo velike.
Razumevanje sil van der Waalsa omogoča kvalitativno napovedovanje številnih fizikalnih lastnosti kemičnih snovi, kot so njihove točke taljenja in vrelišča ter topnost v različnih vrstah topil. To so sile, ki omogočajo, da pojasnijo, kako je mogoče, da se lahko monoatomski plin, kot je helij, ki ne tvori nobene vrste kemične vezi, kondenzira in se premakne v tekoče stanje.
Te sile pojasnjujejo tudi, zakaj je snov, kot je voda, ki jo tvorijo molekule, katerih molarna masa je le 18 g/mol, je tekoča, medtem ko je klor, ki tehta skoraj 4 -krat več, plin pri sobni temperaturi pri sobni temperaturi.
Značilnosti sil Van der Waals
Poleg tega, da predstavljajo vrsto privlačnosti med atomi in molekulami. Nato so predstavljene najbolj izjemne značilnosti te vrste sil:
- So sile, odvisne od razdalje. V najpreprostejšem primeru se zmanjšajo s kvadratom razdalje. Poleg tega so močno odvisni od molekularne geometrije.
- V primerjavi s sili privlačnosti, ki se pojavljajo v ionskih, kovalentnih in kovinskih povezavah, so sile van der Waalsa razmeroma šibke.
- Z izjemo interakcij dipol-dipolo so neodvisne temperaturne interakcije.
- So sile kratke stopnje, kar pomeni, da hitro upadajo, ko se atomi in molekule odmikajo.
- So splošne sile, ki se pojavljajo med katerim koli atomom in katero koli molekulo.
- Za razliko od kovalentnih vezi nimajo usmerjenosti. To pomeni, da se bodo vedno pojavile sile Van Der Waalsa, ne glede na orientacijo, s katero se približata dve molekuli, če se dovolj približata.
- Ko se dve molekuli ali atomi preveč približata, postane sila odbojna, kar preprečuje, da bi se molekule medsebojno zrušile.
- So aditivni, kar pomeni, da lahko obstoj številnih hkratnih interakcij, čeprav je precej šibek.
Vrste sil van der Waals
Poleg odbojne komponente, ki zagotavlja, da se atomi in molekule ne zrušijo, obstajajo tri vrste sil van der Waalsa, ki lahko ali ne delujejo hkrati med dvema molekulama ali atomima. Te so predstavljene spodaj:
1. Dipolo-dipolo interakcije ali sile KEESOM
Moč Keesoma je eden od davkoplačevalcev na silo Van der Waalsa. To so sile elektrostatične interakcije, ki se pojavljajo med stalnimi dipoli polarnih molekul, kot so voda, aceton in drugi.
Keesove sile so podobne elektrostatičnim silam med ioni, vendar se od teh razlikuje po tem, da so veliko šibkejše in propadajo s šesto močjo razdalje (torej z r6). Razlog, zakaj so šibkejši, je, da se privlačnost pojavlja med delnimi obremenitvami dipola, namesto celih električnih nabojev kot v primeru ionov.
Te interakcije so podane samo med molekulami in ne med atomi, saj atomi nimajo trajnih dipolnih trenutkov. Poleg tega je Keesova sila obratno sorazmerna s temperaturo, kar pomeni, da se, ko se poveča, Keesova sila zmanjša.
Primeri molekul, ki imajo interakcije dipole-dipolo
Vse polarne molekule imajo med njimi interakcije dipol-dipola. Na primer:
- Dve molekuli acetona.
- Dve molekuli kloroform.
- Molekula cikloheksanona z molekulo acetona.
2. Inducirane dipolo-dipolo interakcije ali sile Debye
Ko se polarna molekula približa atomu ali apolarni molekuli, dipol prvega privabi ali ponavlja elektrone na površini drugega. To povzroči dipol v apolarni molekuli, ki se imenuje inducirani dipol. Nastavljen nov dipol, nato pa sodeluje z originalnim dipolom, ki ustvarja majhno silo privlačnosti.
Vam lahko služi: toplota zgorevanjaTe interakcije med trajnim in induciranim dipolom so ponavadi znane kot Debye Force in so odvisne ne le od razdalje med dvema molekulama ali med polarno molekulo in posameznim atomom, temveč tudi od polarizabilnosti apolarne molekule in velikosti. dipolnega trenutka polarne molekule.
Primeri molekul, ki so sprožile interakcije dipol-dipola
Tovrstne interakcije so podane le med različnimi molekulami, saj je treba eno polarno in da drugega ne. Nekaj primerov je:
- Atom plemenitega plina, kot je argon in polarna spojina, kot je vodikov klorid. V tem primeru pozitivna delna obremenitev v vodiku HCl privabi argonske elektrone Valencije, kar ustvari majhen dipol, ki ga povzroča v slednjem. Če se argon približa atomu klora, bo negativna delna obremenitev odvrnila valenčne elektrone in nastane tudi inducirani dipol.
- Molekularni brominat (Br2) V vodi je bistveno topen, čeprav je apolarna spojina in voda močno polarnega topila. Pojasnilo je deloma posledica visoke polarizabilnosti broma, ki vam omogoča, da oblikujete znatno močne interakcije.
3. Inducirane interakcije dipolo-dipolo ali londonske disperzijske sile
Od vseh sil Van Der Waalsa so najšibkejše londonske disperzijske sile. Te interakcije so podane med vsemi atomi in molekulami zaradi pojava takojšnjih dipolov v katerem koli delu njihove strukture.
Instant dipol je majhen dipol, ki ga tvori asimetrična porazdelitev valenčnih elektronov.
Vam lahko služi: nenasičeni ogljikovodikiKako nastajajo takojšnje dipole?
Ker se elektroni vrtijo okoli jedra, se lahko zgodi, da je naenkrat več elektronov na eni strani kot z druge, kar povzroča dipol. Ta mali dipol hitro izgine, ko se elektroni še naprej gibljejo po jedru, zato jih imenujemo posnetki.
Takojšnje dipole se lahko pojavijo kjer koli v strukturi molekule in v vsakem trenutku jih je lahko veliko. Londonske disperzijske sile so sestavljene iz interakcije med temi trenutnimi časi v eni molekuli in drugim.
Primeri spojin, ki imajo londonske disperzijske sile
Kot rečeno, se te vrste interakcij pojavljajo med vsemi atomi in molekulami. Vendar je v velikih apolarnih molekulah, kjer je mogoče bolje opaziti njegov učinek, saj je v teh primerih edina vrsta medmolekulske interakcije.
Tipičen primer, v katerem so te sile zelo intenzivne, je v primeru alifatskih ogljikovodikov z dolgimi verigami, zlasti v polimerih, kot je polietilen.

