Natrijeva fosfatna struktura, lastnosti, sinteza, uporablja

- 1925
- 33
- Ignacio Barrows
On Natrijev fosfat Je anorganska sol, katere kemična formula je na3Po4. Prejema tudi trisodna imena fosfatov (TSP za kratico v angleščini: Trisodijev fosfat) ali Tribasic natrijevega fosfata, ker popolnoma primanjkuje sposobnosti darovanja vodikovih ionov H+.
Ko na naliv, natrijevi fosfati na aludiramo, se govori o celotnem zbirki soli, hidriranega ali ne, izvira iz elektrostatičnih interakcij med NA+ in po43-. Nekatere od teh soli so celo sestavljene iz natrijevih pirofosfatov ali anorganskih polimerov, ki imajo PO43- kot monomer.
 Urano steklo z natrijevim fosfatnim kristalom. Vir: Ondřej Mangl [javna domena]
Urano steklo z natrijevim fosfatnim kristalom. Vir: Ondřej Mangl [javna domena] Zato se bo, če ne bo specifikacija, vedno nanašala na Na3Po4, In ne na ne2PO4, na2HPO4, Na4Str2Tudi7 Ne nobene druge soli.
Zgornja slika prikazuje videz natrijevega fosfata, ki je videti beli kristali, podobni tistim iz običajne soli ali mize, ali kupljene kot beli amorfni prašek. Na3Po4 lahko tvori več hidratov, saj je NA3Po4· 12h2Ali tistega, ki je najbolj tržen.
Uporablja se predvsem v prehrambeni industriji, v detergentih, športnih dodatkih in služi kot hiperosmotski odvajalo.
[TOC]
Kemična struktura
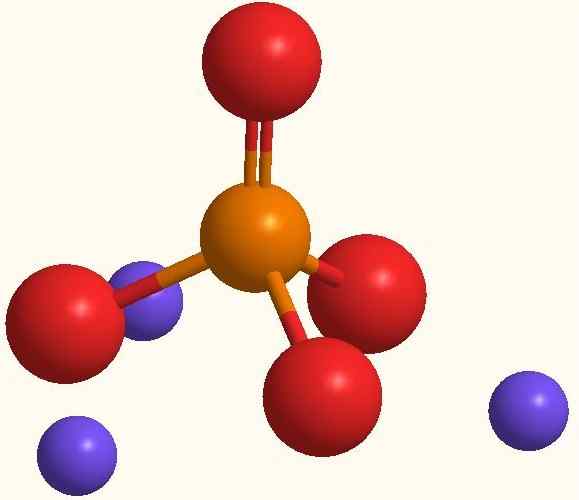 Glavni ioni natrijevega fosfata. Vir: Smolamj prek Wikipedije.
Glavni ioni natrijevega fosfata. Vir: Smolamj prek Wikipedije. Ista for formula3Po4 kaže, da za vsak anion po43- Obstajajo trije kationi+. Te ione lahko opazimo na vrhunski sliki. Upoštevajte, da Po43- Ima tetraedrsko geometrijo, z atomi kisika, ki nosijo resonančno negativno obremenitev, kar privablja NA+ okolja.
Tudi formula NA3Po4 Poudarja, da gre za brezvodno sol, zato v njihove kristale ni molekul vode, ki so vključene. Elektrostatične znamenitosti med+ in po43- Na koncu določijo trigonalni beli kristal. Njegova ionska povezava je takšna, da Na3Po4 Ima fuzijsko točko 1583 ° C, precej višja kot pri več soli.
Vam lahko služi: reakcija Cannizzaro: značilnosti, mehanizmi, primeriOba na+ Kot po43- So ioni, ki jih je mogoče hidrirati v visoki meri, ne da bi negativno vplivali na stabilnost kristalov.
Zaradi tega se lahko tudi hidrati kristalizirajo; Vendar so njegove talilne točke nižje od tistih brezvodne soli, saj medmolekularni vodikovi mostovi vode ločujejo ione in oslabijo njihove interakcije. V NA3Po4· 12h2Ali pa je na primer tališče 73,4 ° C, veliko manj kot na Na3Po4.
Lastnosti
Fizični videz
Se lahko pojavi kot definirani beli kristali ali kot prah ali zrnca iste barve. Vse fizične velikosti, izražene spodaj, aludirajo le na naivno sol3Po4.
Tališče
1583 ° C
Vrelišče
100 ° C
Topnost vode
14,5 g/100 ml pri 25 ° C, zato velja za precej topni vodni fosfat. Vendar je netopna v organskih topilih, kot sta etanol in ogljikov disulfid.
Gostota
2.536 g/cm3 pri 17,5 ° C.
Stabilnost
Je higroskopska trdna. Zato ga je treba shraniti tako, da ga ni mogoče izpostaviti vlagi.
ph
Je močno alkalna sol. Na primer, vodna raztopina od 0,1% že ima pH 11,5. Ta lastnost služi za uporabo kot dodatek v detergentih.
Sinteza
Kako se natrijev fosfat proizvaja ali sintetizira? Če želite to narediti, temelji na fosforjevi kislini, h3Po4, ali iz soli fosfatne soli natrij, ne2Po4.
V veliki večini sinteze je H prednostna3Po4. Tako se reagira h3Po4 Z bazo, ki nevtralizira svoje tri skupine OH, ob upoštevanju, da lahko to kislino zapišemo tudi kot PO (OH)3.
Lahko vam služi: Salmon Balance: kaj je, splošna enačba, vrsteOsnova po preferenci je natrijev hidroksid, NaOH (v Nemčiji), hkrati pa je tudi (in cenejša) uporabljati natrijev karbonat ali Sosa's Ash, NA2Co3 (v ZDA). Enačbe za obe reakciji nevtralizacije so:
Na2Co3 + H3Po4 → NA2HPO4 + Co2 + H2Tudi
Na2HPO4 + NaOH → NA3Po4 + H2Tudi
Upoštevajte, da pri uporabi NA2Co3 Na ni pridobljen3Po4 ampak na2HPO4, ki bo potrebovala poznejšo nevtralizacijo. Ker je vodna reakcija pomeni, kristalizira NA3Po4· 12h2Ali tako ga je treba izračunati, da odpravi vsebnost vode in povzroči brezvodno sol.
Na3Po4· 12h2O Zanj je značilno "združevanje" njihovih kristalov v težki kompaktni masi. Manjša je velikost njihovih kristalov, hitrejša bo njegova kalcinacija.
Prijave
Hrana
 Natrijev fosfat se uporablja kot šumeč sredstvo za širitev vlog cimeta ali torte. Vir: Pixabay.
Natrijev fosfat se uporablja kot šumeč sredstvo za širitev vlog cimeta ali torte. Vir: Pixabay. V natrijevem fosfatu je neizogibno mešati NA3Po4 ali na3Po4· 12h2Ali ker je slednji hidrat, ki je najbolj tržen. Na primer, kateri koli od obeh zagotavlja neškodljive (teoretično) ione hrani, ki ji jih dodajo, in jih obogatijo s fosfati in hkrati povečajo njihovo slanost.
V plašči mesa, NA3Po4· 12h2Ali je vključen, da jih med skladiščenjem ostanejo sveži. Dodamo ga tudi kot emulgirajoči sredstvo, tako da mešanica oljne vode ni "rezana", ampak ostaja združena; In kot regulator PH, ker pomaga zmanjšati kislost hrane (vključno z žitami).
Vam lahko služi: kalcijev silikat: lastnosti, struktura, pridobi, uporabiPoleg tega se uporablja za zgostitev nekaj paradižnikovih omak in za peko torte ali kruha (vrhunska slika). Slednje je zato, ker Na3Po4· 12h2Ali ponavadi sprošča vodno paro, kar poveča velikost pore močne mase in prostornine istega.
Detergenti
Natrijev fosfat je dovolj osnovni, da lahko saponificira nekaj maščob ali olj, s katerimi imate stik. Njegova alkalnost se nato uporablja za izboljšanje delovanja detergentov, dokler površina do bede ni kovinska, saj jo lahko poslabšajo.
Vendar se je proizvodnja detergentov, obogatenih s fosfati.
Uporablja se tudi za izdelavo razkužila: NA3Po4· 1/4naocl · 11h2Ali, ki ga pripravimo z natrijevim hipokloritom, NAOCL, namesto NaOH ali NA2Co3 Za nevtralizacijo h3Po4.
Zdravilno
Na3Po4 Ponuja defekacijo, tako da deluje kot hiperosmotski odvajalec, potreben za čiščenje debelega črevesa, preden bolnik podvrže kolonoskopiji. Po drugi strani je bil uporabljen tudi (dodan) v energetskih dodatkih.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Nacionalni center za informacije o biotehnologiji. (2019). Trisodijev fosfat. Baza podatkov Pubchem. Cid = 24243. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2019). Trisodijev fosfat. Pridobljeno iz: v.Wikipedija.org
- Curran m.Str. & Plosker G.L. (2004). Raztopina peroralnega natrijevega fosfata: pregled njegove uporabe za čiščenje debelega črevesa. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22. december 2017). Natrijev fosfat. Okrevano od: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Postopek za proizvodnjo trisodijevega fosfata. Pridobljeno od: FreePatentssonline.com
- Maryann Marks. (2018). Zakaj v našo hrano dodamo trisodijev fosfat (TSP)? Okrevano od: theingedientguru.com

