Kalijev fluorid (KF)
- 4968
- 710
- Cary Goyette
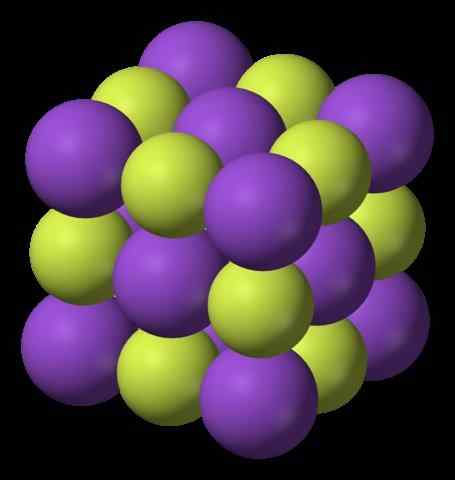
 Struktura kalijevega fluorida. Vir: Benjah-BMM27, Wikimedia Commons
Struktura kalijevega fluorida. Vir: Benjah-BMM27, Wikimedia Commons Kaj je kalijev fluorid?On Kalijev fluorid To je anorganski halogenid, ki je sestavljen iz soli, ki nastane med kovino in halogenom. Njegova kemična formula je KF, kar pomeni, da za vsako kation k+ Obstaja f- kolega. Interakcije so elektrostatične, zato ni kovalentnih povezav K-F.
Za to sol je značilna njegova izjemno topnost v vodi, zato tvori hidrate, absorbira vlago in je okusna. Zato je zelo enostavno pripraviti njene vodne raztopine, ki služijo kot vir fluoridnih anionov za vse tiste sinteze, kjer je želena vključiti v neko strukturo.
KI se proizvaja z reakcijo kalijevega karbonata s fluorhorhorinsko kislino, ki proizvaja kalijev bifluorid (KHF2), ki zaradi toplotne razgradnje na koncu povzroči kalijev fluorid.
Struktura kalijevega fluorida
Zgornja slika prikazuje strukturo kalijevega fluorida. Vijolične sfere predstavljajo katione k+, Medtem ko rumenkaste krogle predstavljajo anione f-.
Upoštevajte, da je razporeditev kubična in ustreza strukturi draguljane soli, zelo podobne konstrukciji natrijevega klorida. Vse sfere je obkroženih s šestimi sosedi, ki sestavljajo oktaedron KF6 ali fk6, to je vsak k+ Obkrožen je s šestimi F-, In enako velja za obratno.
Prej je bilo omenjeno, da je KF higroskopski in zato absorbira vlažnost okolja. Tako bi prikazana razporeditev ustrezala brezvodni obliki (brez vode) in ne njegovim hidratom, ki absorbirajo toliko vode, da se celo solubilizira in "stopi" (delicuescence).
Vam lahko služi: Neon: Zgodovina, lastnosti, struktura, tveganja, uporabeHidrati
Kristalne strukture hidratov postanejo manj preproste. Ker zdaj molekule vode posredujejo neposredno v ureditev in komunicirajo s K ioni+ in f-. Eden najbolj stabilnih hidratov je KF · 2H2O y kf · 4h2Tudi.
V obeh hidratih so novo omenjene oktaedre deformirane zaradi molekul vode. To je predvsem posledica vodikovih mostov med F- in h₂o (f--Hoh). Kristalografske študije so ugotovile, da kljub temu oba iona še naprej ohranjata enako število sosedov.
Kot rezultat, originalna kubična struktura za brezvodni kalijev fluorur.
Anhidrovi delijo delicost.
Lastnosti kalijevega fluorida
- Molekularna teža: 58.097 g/mol.
- Fizični videz (barva): Beli kubični kristali ali delicuescentni kristalni prah.
- Okus: akutni okus fiziološke raztopine.
- Vrelišče: 2.741 ° F pri 760 mmHg (1502 ° C). V tekočem stanju postane prevodnik električne energije, čeprav lahko anioni f- Ne sodelujte v enaki meri pri vožnji kot K+.
- Tališče: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). To kaže na njegove močne ionske povezave.
- Topnost: Topno v HF, vendar netopno v alkoholu. To kaže, da vodikov mostovi med fluoridom in alkoholi, F--Hor, ne dajejo prednost postopku solvacije proti razpadu njene kristalne mreže.
- Topnost vode: brezvodni 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihidrardeni 349,3 g/100 ml (18 ° C). Torej, ker je KF hidriran, postane bolj topna v vodi.
- Gostota: 2,48 g/cm3.
- Parni tlak: 100 kPa (750 mm Hg) pri 1.499 ° C.
- Razgradnja: Ko se segreje na razgradnjo, oddaja strupeni dim iz kalijevega oksida in vodikovega fluorida.
- Jedko dejanje: Vodna raztopina korodira steklo in porcelan.
- Plamenišče: To ni vnetljiva snov
- Eksperimentalni indeks refrakcije (ηD): 1.363.
- Stabilnost: stabilen, če je zaščiten pred vlago, saj se v nasprotnem primeru raztopi trdna snov. Nezdružljivo z močnimi kislinami in bazami.
Uporablja kalijev fluorid
- Prilagodite pH: Vodne raztopine kalijevega fluorida se uporabljajo v industrijskih aplikacijah in procesih. Na primer, KF rešitve omogočajo, da se pH prilagodi v proizvajalcih, ki se izvajajo v predelavi tekstila in pralnic (približno 7).
- Vir fluora: Kalijev fluorid je po vodikovem fluoridu glavni vir pridobivanja fluorida. Ta element se uporablja v jedrskih elektrarnah in pri proizvodnji anorganskih in organskih spojin, nekateri z uporabo, kot je njihova vključitev v dentifrique.
- Sinteza fluorookarbone: Kalijev fluorid se lahko uporablja pri sintezi fluorbone ali fluorkarbida iz klorookarbona z uporabo reakcije Finkeistein. V tej reakciji se kot topila uporabljata etilen glikol in dimetilsulfoksid.
- Fluoriranje: Kot je vir fluora, kjer leži raztopljen v vodi, od svojih raztopin lahko sintetizirajo kompleksne fluoride, to je, da so vgrajeni s F- do struktur. Primer je v naslednji kemični enačbi:
Mnbr2(AC) + 3KF (AC) => kmnf3(s) + 2kbr (AC)
- Nato obori mešani fluorid KMNF3. Tako bi lahko dodali f- biti del zapletene kovinske soli. Poleg mangana lahko fluoridi drugih kovin hitijo: KCOF3, Kfef3, Klif3, Kcf3 in kznf3.
- Prav tako lahko fluorid kovalentno vključimo v aromatičen obroč, ki sintetizira organizacijo.
- Več: KF se uporablja kot vmesni ali surovi material za sintezo spojin, ki se uporabljajo predvsem v agrokemiji ali izdelkih s pesticidi.
- Poleg tega se uporablja kot ustanovni agent Weld.
Reference
- Kalijev fluorid. Okreval iz kemijske knjige.com.
- Kalijev fluorid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.

