Magnezijeva fluoridna struktura, lastnosti, sinteza, uporablja
- 3784
- 72
- Barry Ernser
On Magnezijev fluorid Je brezbarvna anorganska sol, katere kemijska formula je mgf₂. V naravi ga najdemo kot mineral Sealíta. Ima zelo visoko fuzijsko točko in je v vodi zelo malo topen. Je relativno inerten, ker je na primer njegova reakcija na žveplovo kislino počasna in nepopolna in se upira hidrolizi s fluorhorično kislino (HF) do 750 ° C.
Je spojina, ki jo visoko vpliva visoko energetsko sevanje. Poleg tega ima indeks nizkega loma, visoko korozijsko odpornost, dobro toplotno stabilnost, pomembno trdoto in odlične lastnosti prenosa svetlobe, UV (ultravijolični) in IR (infrardeča).

Te lastnosti imajo v optičnem polju odlične zmogljivosti, poleg tega pa so uporaben material, kot so podpora za katalizator, element prevleke, anti -refleksne leče in okna za infrardeči prenos, med drugimi aplikacijami.
[TOC]
Struktura
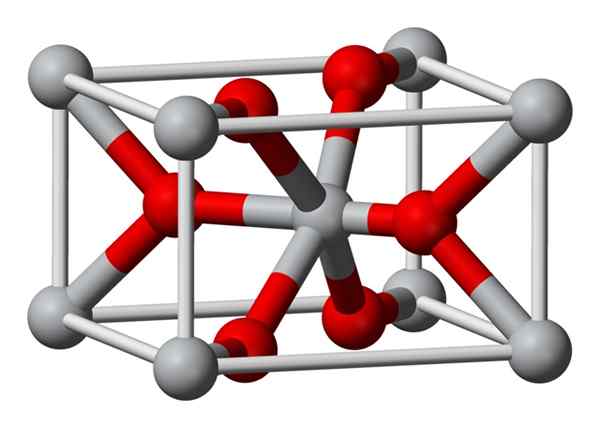
Kristalna struktura magnezijevega fluorida, pripravljena kemično, je enaka vrsta kot v naravnem mineralu Sellaíta. Kristalizira v dipiramidalnem razredu tetragonalnega sistema.
Magnezijevi ioni (Mg2+) so nameščeni v tetragonsko usmerjenem prostoru, medtem ko fluoridne ione (F-) najdemo v isti ravnini njihovih sosedov Mg2+ in povezane s temi, združene v pari z vsakim z vsakim parom. Razdalja med mg2+ in f-ioni je 2,07 Å (angstromi) (2,07 × 10-10m).
Njegova kristalna koordinacija je 6: 3. To pomeni, da je vsak mg2+ ion obkrožen s 6 ioni f- in vsak ion f-, obkrožen s 3 mg2+ 5 ioni.
Struktura je zelo podobna strukturi minerala Rutilo, ki je naravna oblika titanovega dioksida (TiO2), s katero ima več skupnih kristografskih lastnosti.
Med pridobivanjem se magnezijev fluorid ne obori v obliki amorfne trdne snovi, ker Mg2+ in F-ioni ne tvorijo polimernih kompleksov v raztopini.
Lastnosti
Zanimivo je poudariti, da je magnezijev fluorid birrefringov material. To je optična lastnost, ki vam omogoča, da razgrnete žarek incidentne svetlobe v dva ločena žarka, ki se širijo na različnih valovih in valovnih dolžinah.
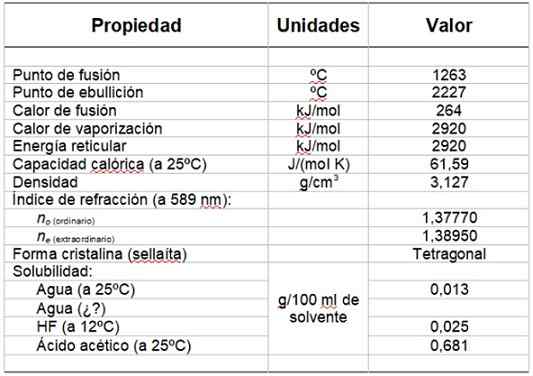
Vam lahko služi: hidroksilna skupinaTabela 1 prikazuje nekaj njegovih lastnosti.
Tabela 1. Fizikalne in kemijske lastnosti magnezijevega fluorida.
Sinteza in priprava
Pripravimo ga lahko na več načinov, med katerimi je mogoče omeniti naslednje:
1, ker reakcija med magnezijevim oksidom (MgO) ali magnezijevim karbonatom (MGCO3) s fluoridno kislino (HF) 2:
MGO + 2 HF MGF2 + H2O
MGCO3 + 2 HF MGF2 + CO2 + H2O
2-za reakcijo med magnezijevim karbonatom in amonijevim bifluorurojem (NH4HF2), obema v trdnem stanju, pri temperaturi med 150 in 400 ° C2:
150-400 ° C
MGCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-kalento Vodna raztopina magnezijevega karbonata in amonijevega fluorida (NH4F) v prisotnosti amonijevega hidroksida (NH4OH) pri 60 ° C 2:
60 ° C, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Oborino amonijevega in magnezijevega fluorida (NH4MGF3) se nato 4 ure segreje na 620 ° C, da dobimo magnezijev fluorid:
620 ° C
NH4MGF3 MGF2 + NH3 + HF
4-kot stranski produkt pridobivanja berilija (BE) in urana (u). Fluorid želenega elementa s kovinskim magnezijem se segreva v talilnem loncu MGF2 2 -pokrito:
Bef2 + mg be + mgf2
5-kratni reakcijski magnezijev klorid (MGCL2) z amonijevim fluoridom (NH4F) v vodni raztopini pri sobni temperaturi 3:
25 ° C, H2O
MGCL2 + 2 NH4F MGF2 + 2NH4Cl
Ker so metode priprave MGF2 drage, obstajajo poskusi, da bi ga pridobili bolj ekonomsko, med katerimi metoda za proizvodnjo iz morske vode.
Vam lahko služi: kalcijev hidrid (CAH2): lastnosti, reaktivnost in uporabaZa to je značilno dodajanje dovolj fluoridnih ionov (F-) v morsko vodo, ki ima obilno koncentracijo magnezijevih ionov (MG2+), kar daje prednost padavini MGF2.
Kristali optičnega magnezijevega fluorida dobimo z vročim tlakom iz visokokakovostnega MGF2, na primer z metodo NH4HF2.
Obstaja veliko tehnik za pripravo magnezijevih fluoridnih materialov, kot so posamezna rast stekla, sintranje (stiskanje do plesni ali oblike) brez tlaka, vroče in sintranje stisnjene z mikrovalovno pečico.
Prijave
Optika
Kristali MGF2 so primerni za optične aplikacije, ker so pregledni od UV regije do IR povprečnega 2,10 regije.
Kot inertni film se uporablja za spreminjanje lastnosti prenosa svetlobe optičnih in elektronskih materialov. Ena glavnih aplikacij je v VUV optiki za tehnologijo raziskovanja vesolja.
Ta material je zaradi svoje lastnosti Birrefringency uporaben pri polarizacijski optiki, v laserskih oknih in prizmah ECimer (ultravijolični laserski tip, ki se uporablja pri očesni kirurgiji).
Treba je opozoriti, da mora biti magnezijev fluorid, ki se uporablja pri proizvodnji optičnih materialov tankega filma ), Sulfatni ioni (SO4 =) in podobni 12.
Kataliza ali pospeševanje reakcij
MGF2 je bil uspešno uporabljen kot katalizatorska podpora za reakcijo izločanja klora in dodajanje vodika v CFC (klorofluoroogljikovodiki), dobro znana hladilnica in aerosolna pogonska goriva ter odgovorna za poškodbo atmosfere ozonske plasti atmosfere.
Nastale spojine, HFC (hidrofluorookarbone) in HCFC (klororofluorookarbore) ne predstavljajo tega škodljivega učinka v atmosfero 5.
Koristno je tudi kot podpora katalizatorju za hidrodesulfracijo (izločanje žvepla) organskih spojin.
Vam lahko služi: kemično ravnovesje: razlaga, dejavniki, vrste, primeriDruge uporabe
Materiali, ki jih ustvarijo grafit, fluor in MGF2.
Eutctic, ki jo tvorita NAF in MGF2, predstavlja lastnosti shranjevanja energije v latentni toploti, zato je bila upoštevana za uporabo v sistemih za sončno energijo.
Na področju biokemije se magnezijev fluorid, skupaj z drugimi kovinskimi fluoridi, uporablja za zaviranje reakcij prenosa fosforila v encimih.
V zadnjem času so bili nanodelci MGF2 uspešno testirani kot vektorji namestitve zdravil v bolnih celicah za zdravljenje raka.
Reference
- Buckley, h.In. in Vernon, w.S. (1925) xciv. Kristalna struktura magnezijevega fluorida. Filozofska revija serija 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije, letnik 11, Peta izdaja, John Wiley & Sons. ISBN 0-471-52680-0 (V.enajst).
- Peng, Minhong; Cao, Weiping; in pesem, Jinhong. (2015). Priprava mgf2 prosojne keramike z vročim stiskanjem. Journal of Wuhan University of Technology-Mater: SCI. Ed. Vol. 30 Ne. 4.
- Nepokonov, l.С. (2011). Fluorid magnezij. Vir: lastno delo.
- Wojciechowska, Maria; Zielinski, Michal; in Piettowski, Mariusz. (2003). MGF2 kot nekonfvencionalna podpora katalizatorja. Journal of Fluore Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluoridni magnezij (MGF2). Posvetoval se je 12.07.2019 v: Korth.od
- SEVONKAEV, IGOR in MATIJEVIC, EGON. (2009). Oblikovanje delcev magnezijevega fluorida različnih morfologij. Langmuu 2009, 25 (18), 10534-10539.
- Nepokonov, l.С. (2013). Fluorid magnezij. Vir: lastno delo.
- Tao Qin, Peng Zhang in Weiwei Qin. (2017). Nova metoda za sintezo nizkocenovnih magnezijevih fluoridnih sfer iz morske vode. Ceramics International 43 (2017) 14481-14483.
- Ullmannova enciklopedija industrijske kemije (1996) Peta izdaja. Zvezek A11. VCH Verlagsgellschaft MBH. New York. ISBN 0-89573-161-4.
- NASA (2013). Inženirji, ki pregledajo primarno ogledalo Hubble Space Telescope 8109563. Vir: mešanica.MSFC.lonec.Gov
- « Piktografski izvor pisanja, značilnosti in primeri
- Značilnosti in primeri komercialnih transakcij »

