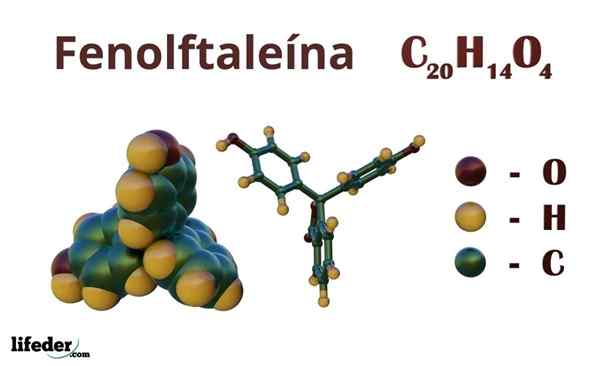
Fenolphtalein (C20H14O4)
- 2538
- 2
- Adrian Legros
Kaj je fenolftalein?
The fenolftalein Gre za organsko barvilo, ki je v zraku šibka diprotična kislina, ki se uporablja v številnih volumetričnih določanju kot kazalnik kisline baze. Se pravi, če gre za diprotično kislino, v raztopini lahko izgubite dva h iona+, Če želite biti kazalnik, morate imeti lastnost barv v območju pH, ki se ceni.
V osnovnem mediju (ph> 8) je fenolftalein roza, ki jo je mogoče stopnjevati na vijolično rdečo. Če želite uporabiti kot kazalnik kisline, ne smete hitreje reagirati z OH- okolja, ki analizira.
Poleg tega, ker gre za zelo šibko kislino, je prisotnost skupin -Cooh izključena in je zato vir kislinskih protonov dve skupini OH, povezani z dvema aromatičnimi obroči.
Formula
Fenolftalein je organska spojina, katere kondenzirana kemična formula je cdvajsetH14Tudi4. Čeprav morda ni dovolj, da bi odkrili, katere organske skupine imajo, od formule lahko izračunate nenasičenost, da začnete razjasniti svoje okostje.
Kemična struktura
 Struktura fenolftaleina
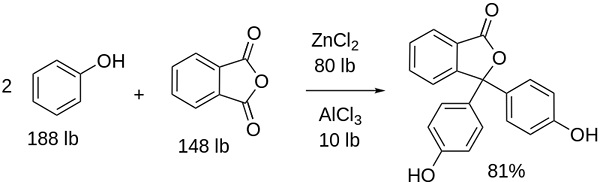
Struktura fenolftaleina Struktura fenolftaleina je dinamična, kar pomeni, da se spreminja, odvisno od pH okolice. Na vrhunski sliki je prikazana struktura fenolftaleina v območju 0 Največje modifikacije trpi pentagonalni obroč. Na primer v osnovnem mediju, ko je ena od skupin OH fenolnih obročev, njihova negativna obremenitev (-o-) privlači aromatičen obroč, "odpiranje" peteganalnega obroča v novi ureditvi njegovih povezav. Tu se nova negativna obremenitev nahaja v skupini -Coo-, ki se je "spustil" iz peclagonskega obroča. Potem je po povečanju bazičnosti medija druga OH skupina fenolnih obročev in nastala obremenitev v celotni molekularni strukturi uničujoča. Inferiorna slika povzema rezultat dveh ne -deprotonacije v osnovnem mediju. Ta struktura je odgovorna za znano roza obarvanost fenolftaleina. Elektroni, ki "potujejo" skozi konjugirani π sistem (predstavljen z dvojnimi resonančnimi vezmi), absorbirajo v vidnem spektru, zlasti na valovno dolžino rumene barve. Fenolphtalein ima skupaj štiri strukture. Prejšnja dva sta najpomembnejša v praktičnem smislu in sta predstavljena skrajšana kot: h2V in v2-. Fenolftalein se uporablja pri kemijski analizi kot vizualni indikator pri določanju enakovrednosti v nevtralizacijskih reakcijah ali kislinskih stopnjah. Reagent za te ocene kisline se pripravi pri 1 %, raztopljenem pri 90 % alkoholu. Fenolphthalein predstavlja 4 države: To vedenje je omogočilo uporabo fenolftaleina kot pokazatelj karbonacije betona, ki pH spreminja do vrednosti med 8,5 do 9. Tudi sprememba obarvanosti je zelo nenadna; to je anion v2- Roza nastaja z veliko hitrostjo. Posledično vam to omogoča, da ste kandidat kot kazalnik v številnih volumetričnih določitvah; Na primer, šibka kislina (ocetna kislina) ali močna (klorovodikova kislina). Fenolphtalein je bil uporabljen kot odvajalni sredstvo. Vendar pa obstaja indikativna znanstvena literatura, da bi lahko nekatera odvajala, ki vsebujejo fenolftalein kot aktivno načelo - ki deluje, ki zavira absorpcijo vode in elektrolitov v debelem črevesju, ki spodbujajo evakuacije - negativne učinke. Dolgotrajna uporaba teh zdravil, ki vsebujejo fenolftalein, je povezana s proizvodnjo več motenj pri črevesni funkciji, pankreatitisu in celo raku, ki se proizvaja predvsem pri ženskah in v živalskih modelih, ki se uporabljajo za farmakološko študijo te kemične spojine. Kenolftalein, nato pa ga pretvori v svoje zmanjšano stanje, se uporablja kot reagent v forenzičnih testih, ki omogočajo določitev prisotnosti hemoglobina v vzorcu (Kastle-Meyer test), kar ni prepričljivo zaradi prisotnosti lažnih pozitivnih. Nastaja s kondenzacijo ftalnega anhidrida s fenolom, v prisotnosti koncentrirane žveplove kisline in mešanico aluminija in cinkovih kloridov kot katalizatorjev reakcije: Aromatična elektrofilna substitucija je mehanizem, ki ureja to reakcijo. Iz česa je sestavljeno? Fenolni obroč (molekula leve) je negativno naložen zaradi atoma kisika, bogatega z elektroni, ki lahko naredi kateri koli prosti par, ki potuje "po elektronski vezji" obroča. Po drugi strani pa ogljik skupine c = o ftalnega anhidrida. Fenolni obroč, bogat z elektroni, napade ta slab ogljik v elektrone in v strukturo vključuje prvi obroč. Ta napad se zgodi prednostno na nasprotnem koncu ogljika, povezanega s skupino OH; To je položaj -za. Enako velja za drugi obroč: napade isti ogljik in od tega se sprosti molekula vode, ki se sprosti zahvaljujoč kislemu mediju. Na ta način fenolftalein ni nič drugega kot ftalna anhidridna molekula, ki je v eno od svojih skupin karbonila vključila dva fenolna obroče (C = O). Njegov fizični videz je bela trdna trdna s trikliničnimi kristali, pogosto aglomerirana ali v obliki rombičnih igel. To je stranišče, gostejše kot tekoča voda (1,277 g/ml pri 32 ° C) in zelo malo hlapnega (ocenjeni tlak v pari: 6,7 x 10-13 mmhg). V vodi je zelo malo topen (400 mg/L), vendar zelo topen v alkoholih in etru. Zaradi tega je priporočljivo, da ga razredčite v etanolu. Je netopna v aromatičnih topilih, kot sta benzen in toluen, ali v alifatskih ogljikovodikih, kot je n-heksan. Najdeno pri 262,5 ° C in tekočina ima vrelišče 557,8 ± 50,0 ° C do atmosferskega tlaka. Te vrednosti kažejo na močne medmolekularne interakcije. To je posledica vodikovih mostov, pa tudi sprednjih interakcij med obroči. Njegov PKA je 9,7 do 25 ° C. To pomeni zelo nizek trend, da se disociira v vodnem mediju: H2V (ac) + 2h2Ali (l) v2-(AC) + 2H3Tudi+ To je vodno ravnovesje. Vendar povečanje OH ionov- V raztopini se sedanja količina H zmanjšuje3Tudi+. Posledično se ravnotežje premakne v desno, da ustvari več H3Tudi+. Na ta način je njegova začetna izguba nagrajena. Ko je dodano več baze, se ravnotežje še naprej premika v desno in tako naprej, dokler vrste ne ni nobene vrste h2V. Na tej točki vrste v2- ROSADO barvanje raztopine. Končno se fenolftalein razpade pri segrevanju, oddajanju hektarja in dražilnega dima.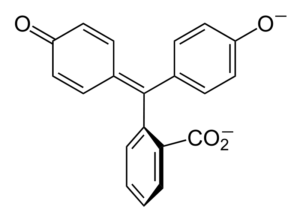
Uporaba/uporaba fenolftaleina
 Dodajanje alkalne raztopine v nevtralno raztopino z indikatorjem fenolftaleina
Dodajanje alkalne raztopine v nevtralno raztopino z indikatorjem fenolftaleina Indikatorska funkcija
Uporaba v medicini
Sinteza fenolftaleina
Lastnosti fenolftaleina
Reference