Struktura eurouo, lastnosti, pridobivanje, uporabe

- 884
- 193
- Raymond Moen
On Europ Gre za kemični element, ki pripada redkim zemljam, ki ga predstavlja kemični simbol EU, in katerih ime je očitno treba evropsko celino. To je najbolj reaktivno za redke zemeljske kovine, ki primerja litij, kalcij in barij, zato je njegova mineraloška difuzija zelo razpršena.
To je ena najbolj redkih in najbolj dragih kovin zaradi vseh postopkov, ki jih je treba opraviti brez nečistoč. Fizično kaže sivkast zlati sijaj, ki ga povzroča njegova hitra oksidacija, komaj je izpostavljen zraku. Zato ga je redko mogoče shraniti s svojo pristno srebrno barvo.
 Oksidirani evropski. Vir: Hi-Res Slike kemičnih elementov/cc by (https: // createCommons.Org/licence/by/3.0
Oksidirani evropski. Vir: Hi-Res Slike kemičnih elementov/cc by (https: // createCommons.Org/licence/by/3.0 Europium je tako reaktiven, da ga je treba shranjevati v ampulah ali zaprtih posodah pod inertno argonsko atmosfero. Celo potopljeno v mineralno olje oksidira mali raztopljeni kisik.
Izjemna značilnost evropija je njegova luminiscenca, še posebej opažena v njegovih spojinah z oksidacijsko številko +3, kot so ZDA2Tudi3, ki je rdeč fosfor, ki se uporablja v neskončnosti elektronskih naprav, in tudi na evros vozovnicah, da se prepreči svoje ponarejanje.
[TOC]
Europsio Discovery
Odkritje europija je nastalo v delih, v devetnajstem stoletju in v različnih državah (Švedska, Nemčija in Švica) evropske celine. Eurobium ione je bilo težko prepoznati, ker so njihovi absorpcijski spektri pomešani z drugimi redkimi zemeljskimi kovinami, kot so Hill, Gadolinium in Lanthean, pa tudi Samarium.
Zato je identifikacija in izolacija vseh teh kovin izvlečela evropij kot nečistoč, ne da bi označila. Na primer, izolacija čistega vzorca Cerio, leta 1839 Carl Gustav Mosander, je imela kot izdelek prepoznavanje drugih novih elementov: Lantano in Didimio.
Med preučevanjem Didimio in zaključkom je bilo doseženo, da je res sestavljen iz mešanice drugih elementov (proseodimij in neodimij), se je pojavil Samario, ki ga je leta 1879 našel Paul èmile Lecoq.
Vam lahko služi: aluminijski hidrid (ALH3): struktura, lastnosti, uporabeKasneje, leta 1886, je švicarski kemik Jean Charles Galissard očistil vzorce Samariuma, ki so našli Gadolinio. Lecoq za leto 1892 je že preučeval spektre Gadolinio in spekter drugega novega elementa.
Petnajst let pozneje, leta 1901, je francoski kemik Eugène Anatole DeMarcay končno izoliral ta novi element in ga krstil kot Evropsko v čast Evrope.
Kemična struktura europija
Atomi Europius ostajajo združeni zahvaljujoč kovinski vezi, v njem pa sodelujejo elektroni njihovih orbital 4F in 6S. Kot rezultat svojih elektronskih značilnosti, atomskih radijskih sprejemnikov in načina embalaže, eurorij na koncu sprejme kubično kristalno strukturo, osredotočeno na telo (BCC), ki je ena najmanj gostih.
Ni bibliografskih virov, ki bi omenjali še en polimorf za Evropo, razen omenjene faze BCC, v drugih temperaturnih območjih; Toda pod različnimi pritiski.
Na primer, europium, ki je bil pod pritiskom, ki je blizu 18 GPa.5 GPA.
Elektronska konfiguracija
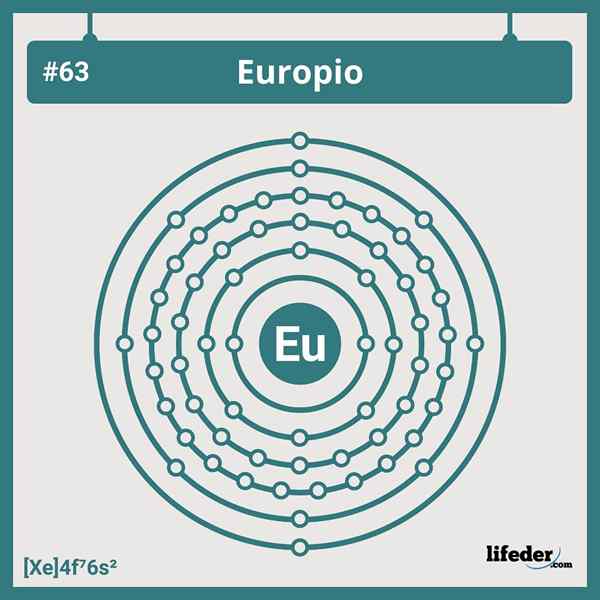 Elektronska konfiguracija evropije
Elektronska konfiguracija evropije Skrajšana elektronska konfiguracija evropija je:
[Xe] 6s24f7
Ker je v položaju ali skupini 7 serije Lantanide, ima sedem elektronov, ki zasedajo njegove 4F orbitale; In zato ne ustreza nobeni od odstopanj, ki jih najdemo v elektronskih konfiguracijah za elemente periodične tabele.
Lastnosti Europeio
Fizični videz
Srebrna bela kovina, mehka trdota, podobna svincu in ki postane zlata, ko je izpostavljena zraku, pokriva plast oksida in karbonata.
Atomska številka
63
Molarna masa
151.96 g/mol
Tališče
826 ° C
Vrelišče
1529 ° C
Gostota
Trdna: 5.264 g/cm3
Na tališču: 5.13 g/cm3
Stanja oksidacije
Glavna oksidacijska stanja evropija so +2 (EU2+) in +3 (EU3+), Biti +1 (EU+) Najmanj skupno od treh.
Vam lahko služi: Polarna kovalentna povezava: značilnosti in primeriIonizacijske energije
-Prvi: 547.1 kJ/mol (EU+ plinasto)
-Drugi: 1085 kJ/mol (EU2+ plinasto)
-Tretjič: 2404 kJ/mol (EU3+ plinasto)
Elektronegativnost
1.2 na lestvici Pauling.
Magnetni vrstni red
Paramagnet
Reaktivnost
Reaktivnost europija je primerljiva z reaktivnim litijem in je zato najbolj reaktivna kovina redkih zemljih. Na primer, hitro reagirate z vodo, da tvori ustrezen hidroksid, EU (OH)3, Rumena, ki za razliko od alkalnih hidroksidov netopna v vodi:
2 EU + 6 h2O → 2 EU (OH)3 + 3 h2
Tudi, ko gori v lažji oksidirani v ZDA2Tudi3 In zavrnil rdečkast plamen, ki spominja na litij:
4 EU + 3 o2 → 2 EU2Tudi3
Europium lahko tvori številne spojine z oksidacijskim stanjem +2, ker ima svoje orbitale F Napol polno (4f7), kar daje svojemu atomu nenavadno elektronsko stabilnost.
EU kation2+ predstavlja kemično vedenje, podobno kot pri BA2+, Toda za razliko od slednjih deluje kot zmerno močno reducirajoče sredstvo, ki oksidira ZDA3+.
Pridobivanje
Surovina
Europium je prisoten v redkih zemeljskih mineralih, kot sta Badnasita in Monazit. Ker pa ohranja nekaj podobnosti z alkalnimi in alkalnimi kovinami glede na njihovo reaktivnost, so njihovi ioni zelo raztreseni v zemeljski skorji poleg kalcijevih mineralov ali drugih kovin. Zato je vaše pridobivanje zelo drago.
Procesi
Ioni EU3+ So del številnih rje in redkih zemeljskih fosfatov. Zato je prvi korak, da jih ločite od drugih prisotnih kovin. Da bi to naredili, se predelajo minerali, zlasti basnazit; Dotaknejo se, raztopijo se v močnih kislinah ali bazah, frakcionirane padavine pa so podvržene z uporabo različnih reagentov. Prav tako se ionska izmenjava kromatografija uporablja za ločevanje ZDA3+.
Ko se mineral predela, dobimo koncentrat ionov EU3+, ki jih je mogoče zmanjšati s kovinskim cinkom ali njenim amalgamom, tako da se zmanjšajo na ZDA2+. Potem ZDA2+ Kopricipita na karbonatu ali barijevem sulfatu.
Vam lahko služi: katalitična hidrogenacijaTa oborina se zadrži in se loči, da dobimo EU oksid2Tudi3, ki se z Lantanom zmanjša v talilnem loncu Tantalio.
Druga metoda za pridobitev europija je izvedba elektrolize mešanice EUCL3 in NaCl ali Cacl2 molten. Tako se na anodi pojavlja klor plin, medtem ko se v katodi oblikuje kovinska evropska.
Uporaba/aplikacije
 Rdečkasta luminiscenca, ki jo vidimo v tej evro vozovnici, pod UV svetilko, je posledica evropske spojine. Vir: Repro by h. Grobe/cc by (https: // createCommons.Org/licence/by/3.0
Rdečkasta luminiscenca, ki jo vidimo v tej evro vozovnici, pod UV svetilko, je posledica evropske spojine. Vir: Repro by h. Grobe/cc by (https: // createCommons.Org/licence/by/3.0 Evropski v svoji kovinski obliki nima rutinske uporabe. Vendar so njegove spojine druga zgodba, zlasti njegov eu oksid2Tudi3, katerega fosforescenca je naredila nepogrešljiva komponenta zaslonov na napravah, monitorjih in televizijah. To je zato, ker gre za rdeč fosfor, ki oddaja značilno rdečo luč.
Rdečkasta fosforescenca Europa (III) se uporablja tudi za preprečevanje ponarejanja evropskih vozovnic, ki osvetljujejo z UV svetlobo, da se potrdi legitimnost.
Po drugi strani pa se v kozarcu fluorescentnih svetilk zelo ponavlja, ob mešanici evro (ii) spojin, ki so modrikaste tekme.
Europium dodamo v majhnih količinah, da se stroncija aluminata za pripravo fosforov različnih barv, ki izstopajo za dolgoročno fosforescenco.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Nacionalni center za informacije o biotehnologiji. (2020). Europium. Povzetek elementov Pubchem. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2020). Europium. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (2020). Europium. Okrevano od: Britannica.com
- R. J. Mož et al. (27. avgust 2012). Europium-iv: nehote. Obnovi se od: revije.AP.org
- David. Skowron. (26. november 2017). Za kaj se uporablja evropij? - Pogoste in zgodovinske uporabe. Študij. Okrevano od: študij.com
- Doktor. Doug Stewart. (2020). Dejstva Europium Elementa. Okrevano od: Chemicool.com

