Terciarna struktura glavnih značilnosti značilnosti

- 1385
- 162
- Don Nitzsche
The Terciarna struktura beljakovin Polipeptidne verige pridobijo tridimenzionalna konformacija, ko se zložijo na sebe. Ta konformacija se pojavlja z interakcijami med stranskimi verigami aminokislinskih odpadkov polipeptida. Stranske verige lahko delujejo neodvisno od svojega položaja v beljakovinah.
Ker je odvisno od interakcij med skupinami R, terciarna struktura kaže ne -ponovne vidike verige, saj so te skupine za vsak ostanek aminokislin različne. Po drugi strani je sekundarna struktura odvisna od karboksilnih in amino skupin, ki so prisotne v vseh aminokislinah.
 Terciarna struktura proteina kinaze fosfataze s sekundarnimi strukturami v alfa in beta listu. Vzeti in urejen od: A2-33. Spremenil Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Terciarna struktura proteina kinaze fosfataze s sekundarnimi strukturami v alfa in beta listu. Vzeti in urejen od: A2-33. Spremenil Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Nekateri avtorji predlagajo, da imajo vlaknasti proteini preprosto terciarno strukturo, vendar kljub temu drugi avtorji poudarjajo, da je ta struktura značilna za globularne beljakovine.
[TOC]
Vlaknasti beljakovine
V vlaknastih beljakovinah so polipeptidne verige razporejene v obliki dolgih nitk ali dolgih listov; Na splošno so sestavljeni iz edinstvene vrste sekundarne strukture. Ta sekundarna struktura je v večini primerov pomembnejša od terciarne strukture pri določanju oblike beljakovin.
Njegova biološka funkcija je strukturna, podevna moč in/ali elastičnost organov in struktur, kjer jih najdemo, hkrati pa jih držijo skupaj. Vsi vlaknasti proteini so netopni v vodi, zaradi velike količine hidrofobnih aminokislin, ki jih predstavljajo.
Med temi vlaknastimi beljakovinami so keratini in kolagen. Prve najdemo v povezanih tkaninah in v strukturah, kot so dlake, nohti (α-Queratinas), luske in perje (β-keatini). Kolagen medtem med drugim najdemo v kosteh, kitih in koži.
α-Queratinas
Ti beljakovini so del tako imenovanih vmesnih beljakovin, ki igrajo pomembno vlogo pri citoskeletu večceličnih organizmov. Poleg tega so glavna sestavina dlak, nohtov, volne, rogov, kopit in enega glavnih beljakovin za živalske kože.
Vam lahko služi: kinyoun obarvanjeStruktura molekule je α propeler. Dva sklopa α-Queratina je mogoče vzporedno razporediti in vpisati drug nad drugim s svojimi R hidrofobnimi skupinami, ki med seboj medsebojno delujejo. Na ta način je ustvarjena superhelična ali kroglasta struktura z vijuganjem na levo.
Terciarna struktura α keratina je preprosta in v njej prevladuje sekundarna struktura α-helicsa. Po drugi strani je prisotna tudi kvartarna struktura, saj dve molekuli sodelujeta v superhelikoidni strukturi, ki medsebojno deluje prek ne -kovalentnih vezi.
β-Queratinas
Primarna struktura je podobna kot pri α-kvalinah, vendar njena sekundarna struktura prevladujejo β listi. So glavna sestavina lestvic plazilcev in perja ptic.
Kolagen
Ta protein lahko predstavlja več kot 30% celotne beljakovinske mase nekaterih živali. Najdemo ga v hrustancih, kosteh, kitivah, roženici in koži, med drugimi tkivi.
Sekundarna struktura kolagena je edinstvena, ki jo predstavlja propeler Levogira s 3,3 aminokislinske odpadke za vsak krog. Tri verige propelerjev (α).
Molekule tropokolagena se združijo, da tvorijo kolagenske vlaknine, ki imajo veliko odpornost, višjo od jekla in primerljive z bakrom z visoko odpornostjo.
Drugi vlaknasti beljakovine
Druge vrste vlaknastih beljakovin so fibroin in elastin. Prvi od njih tvorijo β listi, ki jih sestavljajo predvsem glicina, alanin in serin.
Bočne verige teh aminokislin so majhne, zato jih je mogoče tesno zapakirati. Rezultat je vlakna, ki je zelo odporna in zelo neopažena.
Vam lahko služi: fosfatni pufer (PBS): temelj, priprava in uporabaV Elastinu medtem valina nadomešča serin med glavnimi sestavnimi aminokislinami. Za razliko od fibroina je Elastin zelo razširljiv, od tod tudi ime. V ustavi molekule deluje tudi lizin, ki lahko sodeluje pri navzkrižni povezavi, ki omogoča Elastinu, da si povrne obliko, ko napetost preneha.
Kroglični proteini
Globlularni proteini, za razliko od vlakna, so topni in imajo na splošno več vrst sekundarnih struktur. Vendar pa so v teh pomembnejših tridimenzionalnih skladnosti, ki jih pridobijo pri zložitvi na sebe (terciarna struktura).
Te posebne tridimenzionalne konformacije dajejo specifično biološko aktivnost vsakemu beljakovinam. Glavna funkcija teh beljakovin je regulativna, kot pri encimih.
Značilnosti terciarne strukture krogličnih beljakovin
Terciarna struktura krogličnih beljakovin ima nekaj pomembnih značilnosti:
- Globlularni proteini so kompaktni zahvaljujoč embalaži, ko se polipeptidna veriga zloži.
- Oddaljeni aminokislinski odpadki v primarni strukturi polipeptidnih verig so blizu, saj lahko medsebojno komunicirajo zaradi zlaganja.
- Večji kroglični proteini (več kot 200 aminokislin) imajo lahko več kompaktnih segmentov, neodvisnih med njimi in z določenimi funkcijami, vsak od teh segmentov pa se imenuje domena. Domena ima lahko med 50 in 350 aminokislinskih odpadkov.
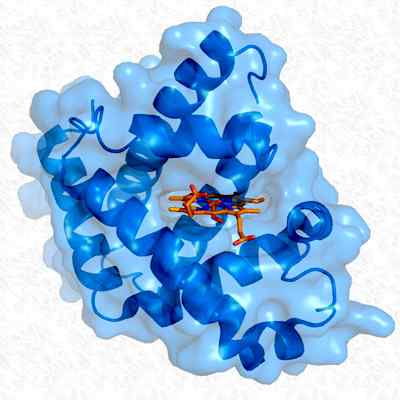 Terciarna struktura mioglobina. Vzeti in urejen od: Thomas Splattstoesser. Spremenil Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Terciarna struktura mioglobina. Vzeti in urejen od: Thomas Splattstoesser. Spremenil Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Splošna pravila zlaganja globalnih beljakovin
Kot že omenjeno, imajo beljakovine posebne zložljive oblike, ki jim dajejo tudi posebne značilnosti. To zlaganje ni naključno in je naklonjeno tako primarni kot sekundarni strukturi kot nekaterih nekovalentnih interakcijah, poleg tega pa obstajajo tudi nekatere fizične omejitve za zlaganje, zato so bila oblikovana nekatera pravila:
Vam lahko služi: primarni limfoidni organi- Vsi kroglični proteini imajo določene vzorce porazdelitve, pri čemer so hidrofobne skupine usmerjene v molekulo in hidrofilne odpadke v zunanji plasti v zunanji plasti. Za to sta potrebna vsaj dve plasti sekundarne strukture. Zanka β-α-β in vrhova α-α lahko prispevata ta dva sloja.
- Β listi so na splošno razporejeni v obliki Levogira.
- V polipeptidni verigi se lahko pojavijo različni zavoji, da se premikajo iz sekundarne v drugo strukturo, na primer β ali γ zavoji, ki lahko lahko vložijo smer verige v štiri aminokislinske odpadke ali manj.
- Globlularni proteini imajo α, β liste, nepravilno strukturirane zasuke in segmente.
Denaturacija beljakovin
Če beljakovine izgubi domačo (naravno) tridimenzionalno strukturo, izgubi svojo biološko aktivnost in večino svojih specifičnih lastnosti. Ta postopek je znan kot denaturacija.
Denaturacija se lahko pojavi, kadar se naravni okoljski pogoji spremenijo, na primer z različno temperaturo ali pH. Postopek je pri mnogih beljakovinah nepopravljiv; Vendar lahko drugi spontano povrnejo svojo naravno strukturo z obnovitvijo normalnih okoljskih pogojev.
Reference
- C.K. Mathews, k.In. Van Hold & K.G. Ahern (2002). Biokemery. 3. izdaja. BENJAMIN / CUMSINGS Publishing Company, Inc.
- R.Murray, str. Mayes, d.C. Granner & v.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & L. Stryer (2002). Biokemery. 5. izdaja. W. H. Freeman in družba.
- W.M. Becker, l.J. Kleinsmith & J. Hardin (2006) svet celice. 6. izdaja. Pearson Education Inc.
- Do.Lehninger (1978). Biokemija. Omega Editions, s.Do.
- T. McKee & J.R. McKee (2003). Biokemija: Molekularna osnova življenja. 3. izdaja. McGraw-hiii Companies, Inc.
- « Fermionske lastnosti, aplikacije in primeri kondenzata
- Struktura dodecila natrijevega sulfata (SDS), lastnosti, uporabe »

