Primarna struktura značilnosti
- 3120
- 897
- Don Nitzsche
The primarna struktura beljakovin To je vrstni red, v katerem so aminokisline, ki so sestavljeni. Protein je biopolimer, ki ga tvorijo monomeri α-aminokislin, združeni skozi peptidne vezi. Vsak protein ima določeno zaporedje teh aminokislin.
Beljakovine izvajajo ogromno raznolikosti bioloških funkcij, vključno z obliko in ohranjanjem celovitosti celic s citoskeletom, branil telo čudnih zdravil s pomočjo protiteles in katalizirajo kemične reakcije organizma prek encimov.
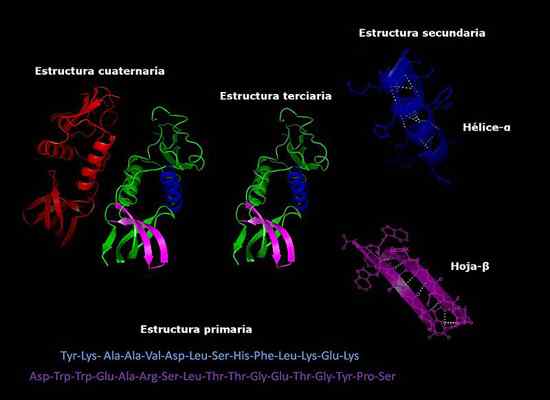
 Primarne, sekundarne, terciarne in kvartarne strukture beljakovin, tridimenzionalna konformacija. Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Primarne, sekundarne, terciarne in kvartarne strukture beljakovin, tridimenzionalna konformacija. Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Trenutno je določitev sestave beljakovin in vrstni red, v katerem so razporejene aminokisline (zaporedje), hitrejše kot pred leti. Te informacije se deponirajo v mednarodnih elektronskih bazah podatkov, do katerih lahko dostopate prek interneta (med drugim Genbank, PIR).
[TOC]
Amino kisline
Aminokisline so molekule, ki vsebujejo amino skupino in skupino karboksilne kisline. V primeru α-aminokislin imajo centralni ogljikov atom (ogljik α), na katerega so združeni, tako amino skupino kot karboksilno skupino, poleg atoma vodika in značilne skupine R, ki se imenuje stran veriga.
Zaradi te konfiguracije α ogljika so aminokisline, ki se tvorijo, znane kot α-aminokisline, kirali. Obstajata dve obliki, ki sta zrcalni slike drug drugega in se imenujeta enantiomeri l in d.
Vsi beljakovini živih bitij tvorijo 20 α-aminokislin konfiguracije l. Stranske verige teh 20 aminokislin so različne in imajo veliko raznolikost kemičnih skupin.
V bistvu je mogoče α-aminokisline razvrstiti (poljubno), odvisno od vrste stranske verige na naslednji način.
Alifatske aminokisline
V tej skupini so po mnenju nekaterih avtorjev glicin (gli), alanin (krilo), valin (val), leucina (leu) in izolevcin (ile) (ile) (ile) (ile) (ile). Drugi avtorji vključujejo tudi metionin (MET) in proline (pro).
Vam lahko služi: fosfolipidi: značilnosti, struktura, funkcije, vrsteAminokisline s stranskimi verigami, ki vsebujejo hidroksil ali žveplo
Vsebuje serin (SER), cistein (Cys), Treonina (Thr) in tudi metuonin. Po mnenju nekaterih avtorjev bi morala skupina vključevati le biti in thr.
Ciklične aminokisline
Integrira samo s prolinom, ki ga, kot je že poudaril, vključujejo drugi avtorji med alifatske aminokisline.
Aromatične aminokisline
Fenilalanin (Phe), tirozin (Tyr) in triphafano (TRP).
Osnovne aminokisline
Histidin (njegov), lizin (lys) in arginina (arg)
Kisle aminokisline in njene amide
Vsebuje aspartinske kisline (ASP) in glutamiko (Glu) ter tudi Aspargine (ASN) in glutamin (GLN). Nekateri avtorji ločijo slednjo skupino na dve; Po eni strani tistega kisle aminokisline (prva dva), na drugi pa tisti, ki vsebujejo karboksilamid (preostala dva).
Peptidne povezave
Aminokisline se lahko med seboj pridružijo s peptidnimi povezavami. Te povezave, imenovane tudi amida povezave, so vzpostavljene med α-amino skupino ene aminokisline in α-karboksilno skupino druge. Ta zveza se oblikuje z izgubo molekule vode.
Združitev med dvema aminokislinah povzroči nastanek dipéptida in če se dodajo nove aminokisline, zaporedno, Tricid, tetrapéptides ipd.
Polipeptidi, ki jih tvori majhno število aminokislin, prejmejo splošno ime oligopeptidov, in če je število aminokislin veliko, se imenujejo polipeptidi.
Vsaka aminokislina, ki se doda v polipeptidno verigo, sprosti molekulo vode. Del aminokisline, ki je med zvezo izgubil H+ ali OH-, se imenuje preostala aminokislina.
Večina teh oligopeptidnih in polipeptidnih verig bo na enem koncu predstavljala amino-terminalno (N-terminalno) skupino, v drugi pa terminalni karboksil (C-terminal). Poleg tega lahko vsebujejo veliko ionizabilnih skupin med stranskimi verigami odpadkov aminokislin, ki jih obsega. Zaradi tega veljajo za polianfoliti.
Vam lahko služi: flora in favna iz Campecheja: reprezentativna vrsta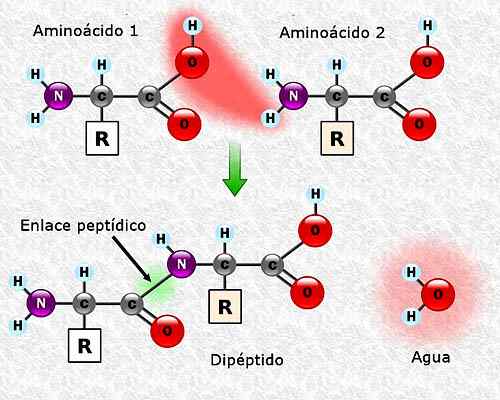 Oblikovanje peptidne povezave med dvema aminokislinama. Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Oblikovanje peptidne povezave med dvema aminokislinama. Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Zaporedje aminokislin
Vsak protein ima določeno zaporedje svojih aminokislinskih odpadkov. Ta red je tisto, kar je znano kot primarna struktura beljakovin.
Vsak posamezen protein vsakega organizma je značilen za vrsto. To pomeni, da je mioglobin človeka enak kot pri drugem človeku, vendar ima majhne razlike z mioglobini drugih sesalcev.
Količina in vrste aminokislin, ki jih vsebuje protein. Za poznavanje beljakovin morajo biokemisti najprej izolirati in očistiti vsak posamezen protein, nato narediti analizo vsebnosti aminokislin in na koncu določiti njegovo zaporedje.
Za izolacijo in čiščenje beljakovin obstajajo različne metode, med katerimi so: centrifugiranje, kromatografija, filtracija gela, dializa in ultrafiltracija, pa tudi uporaba lastnosti topnosti beljakovin, obravnavanih.
Določitev aminokislin, prisotnih v beljakovinah, se izvede po treh korakih. Prva je, da s hidrolizo razbijete peptidne vezi. Nato se različne vrste aminokislin iz mešanice ločijo; In končno, vsaka od vrst pridobljenih aminokislin je količinsko opredeljena.
Za določitev primarne strukture beljakovin se lahko uporabijo različne metode; Toda trenutno je najbolj uporabljena Edmanova metoda, ki je v bistvu sestavljena iz označevanja in ločevanja N-terminalne aminokisline od preostale verige večkrat in identifikacije vsake aminokisline, ki se sprostijo posamično.
Kodiranje beljakovin
Primarna struktura beljakovin je kodirana v organizmu. Genetske informacije so vsebovane v DNK, vendar je treba za prevod beljakovin najprej prepisati na molekule RNM. Vsak nukleotidni trojček (kodon) kodira aminokislino.
Vam lahko služi: kakšna je kemična sestava živih bitij?Ker je 64 možnih kodonov in pri konstrukciji beljakovin uporablja le 20 aminokislin, lahko vsako aminokislino kodira več kot en kodon. Skoraj vsa živa bitja uporabljajo iste kodone za kodiranje istih aminokislin. Zato se genetski kodeks šteje za skoraj univerzalni jezik.
V tej kodi so kodoni, ki se uporabljajo za začetek in tudi zaustavitev prevod polipeptida. Kodoni dokončanja ne kodirajo nobene aminokisline, ampak prenehajo prevod v verižni C-terminal in jih predstavljajo trojčki UAA, UAG in UGA.
Po drugi strani kodon AUG običajno deluje kot začetni signal in tudi kodira metionin.
Po prevodu lahko beljakovine utrpijo nekaj obdelave ali spreminjanja, kot je kratka minljivost, da bi dosegli svojo dokončno konfiguracijo.
Reference
- C.K. Mathews, k.In. Van Hold & K.G. Ahern. 2002. Biokemery. 3th Izdaja. BENJAMIN / CUMSINGS Publishing Company, Inc.
- Murray, str. Mayes, d.C. Granner & v.W. Rodwell. Devetnajst devetdeset šest. Harper's Biochemery. Appleton & Lange
- J.M. Berg, j.L. Tymoczko & L. Stryer (SF). Biokemery. 5th Izdaja. W. H. Freeman in družba.
- J. Koolman & k.-H. Roehm (2005). Atlas biokemijske barve. 2Nd Izdaja. Tiem.
- Do. Lehninger (1978). Biokemija. Omega Editions, s.Do.
- L. Stryer (1995). Biokemery. W.H. Freeman in družba, New York.
- « Zgodovina številk Avogadro, enote, kako se izračuna, uporablja
- Značilnosti, strukture in funkcije eksonukleaze »

