Kvartarna struktura proteinov značilnosti

- 2797
- 573
- Roman Schamberger
The Kvartarna struktura beljakovin definira prostorske odnose med vsako od svojih podenot polipeptidov, povezanih z nekovalentnimi silami. V polimernih beljakovinah se vsaka od polipeptidnih verig, ki jo sestavljajo, imenujejo podenote ali protomeri.
Beljakovine lahko tvorijo en (monomerni), dva (dimérica), več (oligomerni) ali številni protomeri (polimerni). Ti protomeri imajo lahko podobno ali zelo drugačno molekularno strukturo med njimi. V prvem primeru se reče, da gre za homotipske beljakovine, v drugem primeru.
 Primer kvartarne strukture proliferacijskega celičnega jedrskega antigena. Vzeti in urejen od: Thomas Shafee [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)].
Primer kvartarne strukture proliferacijskega celičnega jedrskega antigena. Vzeti in urejen od: Thomas Shafee [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)]. V znanstvenem zapisu biokemisti uporabljajo grška pisma z naročniki, da opišejo sestavo beljakovinskih protomerov. Na primer, tetramerični homotipski protein je označen kot α4, Medtem ko je tetramerični protein, ki ga tvorita dva različna dimera, označen kot α2β2.
[TOC]
Beljakovinska struktura
Beljakovine so zapletene molekule, ki pridobijo različne tridimenzionalne konfiguracije. Te konfiguracije so ekskluzivne za vsako beljakovino in jim omogočajo opravljanje zelo specifičnih funkcij. Ravni strukturne organizacije beljakovin so naslednje.
Primarna struktura
Nanaša se na zaporedje, v katerem so razporejene različne aminokisline v polipeptidni verigi. To zaporedje daje zaporedje DNK, ki kodira tak protein.
Sekundarna struktura
Večina beljakovin ni dolgih verig popolnoma razširjenih aminokislin, ampak ima regije, ki so redno zložene v obliki propelerjev ali listov. Ta zlaganje je tisto, ki se imenuje sekundarna struktura.
Terciarna struktura
Zložena območja sekundarne strukture se lahko zložijo in sestavijo v bolj kompaktnih strukturah. Ta zadnji pregib je tisti, ki beljakovine daje svojo tri dimenzijsko obliko.
Kvartarna struktura
V beljakovinah, ki jih tvori več kot ena podenota, so kvartarne strukture prostorska razmerja, ki obstajajo med vsako podenoto, ki so povezane z nekovalentnimi vezmi.
Vam lahko služi: kako glive dihajo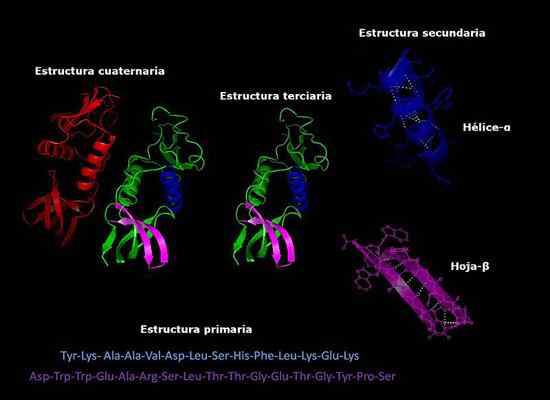 Primarne, sekundarne, terciarne in kvartarne strukture beljakovin, tridimenzionalna konformacija. Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Primarne, sekundarne, terciarne in kvartarne strukture beljakovin, tridimenzionalna konformacija. Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Stabilnost kvartarne strukture
Tri -dimenzionalna struktura beljakovin se stabilizira s šibkimi ali nekovalentnimi interakcijami. Medtem ko so te povezave ali interakcije veliko šibkejše od običajnih kovalentnih vezi, so te številne in njihov kumulativni učinek je močan. Nato bomo videli nekaj najpogostejših interakcij.
Hidrofobne interakcije
Nekatere aminokisline vsebujejo hidrofobne stranske verige. Ko imajo beljakovine te aminokisline, zložljivo molekulo naroči te stranske verige v beljakovine in jih ščiti pred vodo. Narava različnih stranskih verig povzroči, da na hidrofobni učinek prispevajo na različne načine.
Van der Waals interakcije
Te interakcije se pojavijo, ko se molekule ali atomi, ki jih kovalentne vezi ne združujejo.
Takrat se med temi atomi vzpostavi odbojna sila, ki zelo hitro raste, saj njihovi centri približajo. To so tako imenovane sile Van der Waals ".
Interakcije obremenitve
To je elektrostatična interakcija, ki se pojavi med nekaj naloženimi delci. Pri beljakovinah se pojavlja ta vrsta interakcij, tako zaradi neto električnega naboja beljakovin, kot tudi posamezne obremenitve ionov, ki jih vsebuje. Ta vrsta interakcij se včasih imenuje puente salino.
Vodikove vezi
Vodikova vez se s pomočjo pritrjenega vodikovega atoma vzpostavi.
Ta vrsta vezi je zelo pomembna, saj so lastnosti številnih molekul, vključno z vodo in biološkimi molekuli, v veliki meri posledica vodikovih vezi. Delite lastnosti kovalentnih obveznic (elektroni so skupni) in tudi nekovalentne interakcije (interakcija s tovornim obremenitvijo).
Vam lahko služi: prehodni pridelkiDipolosove interakcije
V molekulah, vključno z beljakovinami, ki ne predstavljajo neto obremenitve, je mogoče predložiti neenakomerne razporeditve svojih notranjega obremenitve z nekoliko bolj negativnim koncem kot drugim. To je tisto, kar je znano kot dipol.
To dipolno stanje molekule je lahko trajno, lahko pa ga tudi sproži. Dipolos lahko privlačijo ioni ali drugi dipoli. Če so dipoli trajni, ima interakcija večje možnosti, kot je predstavljeno z induciranimi dipoli.
Poleg teh ne -kovalentnih interakcij nekateri oligomerni proteini stabilizirajo svojo kvartarno strukturo s kovalentno vrsto povezave, disulfidno povezavo. Ti so vzpostavljeni med sulfhidrillo skupinami cisteonov različnih protomerov.
Disulfuro vezi pomagajo tudi stabilizirati sekundarno strukturo beljakovin, vendar se v tem primeru cistein odpadki povezujejo znotraj istega polipeptida (intrapopolipeptidne disulfidne vezi).
Interakcije med protomeri
Kot je bilo že omenjeno, v beljakovinah, ki so sestavljene iz več podenot ali protomerov, so te podenote lahko podobne (homotipske) ali drugačne (heterotipne).
Homotipske interakcije
Podenote, ki sestavljajo beljakovine, so asimetrične polipeptidne verige. Vendar pa je v homotipskih interakcijah te podenote mogoče povezati na različne načine za doseganje različnih vrst simetrije.
Skupine, ki komunicirajo z vsakim protomerom, so na splošno nameščene v različnih položajih, zato jih imenujemo heterologne interakcije. Heterologne interakcije med različnimi podenotami se včasih pojavijo tako, da je vsaka podenota kriva glede na precedens, spiralno strukturo in spiralno strukturo je mogoče doseči.
Ob drugih priložnostih so interakcije navedene tako, da so definirane podenote razporejene okoli ene ali več simetrijskih osi, v tem, kar je znano kot točka - simetrija. Kadar je več osi simetrije, vsaka podenota pokvarjena glede na sosed 360 °/N (kjer n predstavlja število osi).
Lahko vam služi: avstralska flora in favna: reprezentativna vrstaMed vrstami simetrije, ki jih dobimo na ta način, so na primer spiralni, kubični in ikozaedrski.
Ko dve podenoti medsebojno delujeta skozi binarno osi, se vsaka enota lomi 180 ° glede na drugo, okoli te osi. Ta simetrija je znana kot simetrija c2. V njem so interakcijska mesta v vsaki podenoti enaka; V tem primeru ni govora o interakciji heterologa, ampak o izološki interakciji.
Če je nasprotno povezava med obema komponentama dimera heterolog, potem bo pridobljena asimetrični dimer.
Heterotipske interakcije
Ne vedno podenote, ki delujejo v beljakovinah, so enake narave. Obstajajo beljakovine, ki jih tvori dvanajst ali več različnih podenot.
Interakcije, ki ohranjajo stabilnost beljakovin, so enake kot v homotipskih interakcijah, vendar se na splošno popolnoma dobijo asimetrične molekule.
Hemoglobin je na primer tester, ki predstavlja dva para različnih podenot (α2β2).
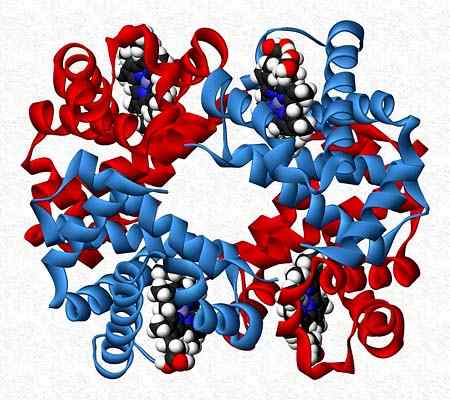 Kvartarna struktura hemoglobina. Vzeti in urejen od: Benjah-BMM27. Spremenil Alejandro Porto. [CC0].
Kvartarna struktura hemoglobina. Vzeti in urejen od: Benjah-BMM27. Spremenil Alejandro Porto. [CC0]. Reference
- C.K. Mathews, k.In. Van Hold & K.G. Ahern (2002). Biokemery. 3. izdaja. BENJAMIN / CUMSINGS Publishing Company, Inc.
- R.K. Murray, str. Mayes, d.C. Granner & v.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange
- J.M. Berg, j.L. Tymoczko & L. Stryer (2002). Biokemery. 5. izdaja. W. H. Freeman in družba.
- J. Koolman & k.-H. Roehm (2005). Atlas biokemijske barve. 2. izdaja. Tiem.
- Do. Lehninger (1978). Biokemija. Omega Editions, s.Do.
- L. Stryer (1995). Biokemery. W.H. Freeman in družba, New York.
- « 19. stoletje v Čili prebivalstvu, družbi, gospodarstvu in politiki
- Vimentinske značilnosti, struktura, funkcije in uporabe »

