Značilnosti plinastega stanja, splošni zakon, primeri

- 3047
- 107
- Cary Goyette
On Plinasto stanje To je stanje združevanja predmeta, pri katerem se delci držijo skupaj s šibkimi interakcijami, saj se lahko premikajo po vseh smeri vsebnika, ki jih vsebuje. Od vseh fizičnih stanj predmeta je plinasti tisti, ki kaže največjo svobodo in kaos.
Plini izvajajo tlak, transportno toploto in so sestavljeni iz katere koli vrste majhnih delcev. Naše vzdušje in zrak, ki ga dihamo, je manifestacija plinastega stanja tukaj na zemlji.
 V izmajinih dimu je mogoče opaziti vedenje plinov, preden se razpršijo skozi ozračje. Vir: Pexels.
V izmajinih dimu je mogoče opaziti vedenje plinov, preden se razpršijo skozi ozračje. Vir: Pexels. Primeri plinov so toplogredni plini, kot so vodna para, ogljikov dioksid, metan ali ozon. Ogljikov dioksid, ki ga izdihujemo pri dihanju, je še en primer plinaste snovi.
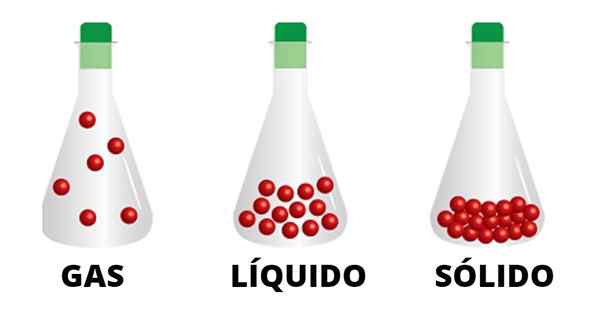 Plinasti delci so povezani s šibkimi interakcijami in se premikajo s kontejnerjem. Opažamo, da so delci tekočega stanja bolj združeni in tisti iz trdnih tesno povezanih
Plinasti delci so povezani s šibkimi interakcijami in se premikajo s kontejnerjem. Opažamo, da so delci tekočega stanja bolj združeni in tisti iz trdnih tesno povezanih Tekočine in trdne snovi, na primer, se ne bodo premaknile na položaje zunaj svojih materialnih meja, kar se ne zgodi s plini. Dim cigaret, dimnikov in stolpov si pokaže, kako se plin dviga in razprši z okoljem, ne da bi ga kaj ustavilo.
[TOC]
Značilnosti plinastega stanja
Manjka glasnosti ali oblike
Za plinasto stanje je značilno, da nima določene oblike ali volumna. Če ni nobenih meja, ki bi ga obdržali, se bo razpršilo po vzdušju. Tudi tako kot pri heliju bo pobegnil zunaj Zemlje.
Plin lahko pridobi samo obliko, ki jo naloži posoda. Če je posoda cilindrična, bo imel plin "obliko".
Vam lahko služi: kalorimetrija: kakšne študije in aplikacijeSlab vročinski voznik
Za to stanje je značilen tudi za slab prevodnik toplote in električne energije. Na splošno je manj gosta v primerjavi s trdnimi in tekočimi stanji.
Ker je večina plinov brezbarvna, na primer kisik in ogljikov dioksid, je mogoče ugotoviti, koliko jih je v posodi s pomočjo njihovega tlaka.
Reagenti
Plini so ponavadi bolj reaktivni, razen plemenitih plinov, kot tekočine ali trdne snovi.
Majhni delci
Plinasti delci so običajno majhni, atomi ali preproste molekule.
Na primer plinasti vodik, h2, Gre za zelo majhno molekulo, ki jo tvorita dva atoma vodika. Imamo tudi helij, katerega atomi so še manjši.
Interakcije
Interakcije v plinastem stanju so zaničljive. To se močno razlikuje od tekočih in trdnih stanj, v katerih so njihovi delci zelo kohezivni in močno delujejo drug od drugega. V molekulah, ki tvorijo tekoče in trdno stanje, med njimi skoraj ni molekulske praznine.
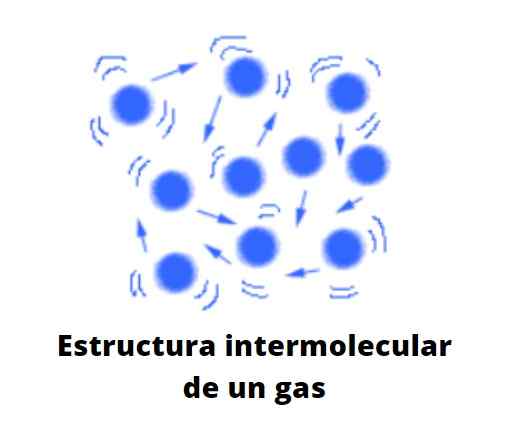
Delci v plinastem stanju so zelo oddaljeni eden izmed drugih, med njimi je veliko praznine. Ni več vakuum v molekularni lestvici. Razdalja, ki jih loči, je toliko, da je vsak delček v plinu prost, ravnodušen do njene okolice, razen če se v svoji kaotični poti z drugim delcem ali ob steni posode.
Vam lahko služi: razredčena raztopinaČe se domneva, da ni zabojnika, lahko praznino med delci plina zasede zrak, kar potisne in vleče plin proti smeri njegovega toka. Zato je zrak, ki je sestavljen iz plinaste mešanice, sposoben deformirati in širiti plinaste snovi, dokler niso veliko bolj gostejši od njega.
Splošno plinsko državno pravo
Eksperimentalna študija vedenja in mehanike plinov je povzročila več zakonov (Boyle, Charles, Gay-Lussac), ki združujejo, da bi napovedovali, kakšni bodo parametri katerega koli plinskega sistema ali pojava prostornina in tlak.
Ta splošni zakon ima naslednji matematični izraz:
P = kt/v
Kjer je k konstanta, p tlak in volumen ter t temperatura plina v Kelvinovi lestvici. Tako je, če poznamo dve spremenljivki (rečem, p in v), tretji mogoče očistiti, kar bi bilo neznano (t).
Ta zakon na primer omogoča, da bi bila temperatura plina, zaklenjena v prostornini V vsebnik, prikazati p tlak.
Če k temu zakonu dodamo prispevek Amadeusa Avogadro, bomo imeli zakon o idealnih plinih, ki vključuje tudi število delcev, z njimi pa molarno koncentracijo plina:
P = nrt/v
Kje n ustreza številu molov plina. Enačbo je mogoče napisati kot:
P = crt
Kje c To je molarna koncentracija plina (n/V). Tako iz splošnega zakona dobimo idealen zakon, ki opisuje, kako se nanašajo tlak, koncentracija, temperatura in prostornina idealnega plina.
Vam lahko služi: presedenoPrimeri plinastega stanja
Plinasti elementi
Ista periodična tabela ponuja dober repertoar primerov elementov, ki so na zemlji predstavljeni kot plini. Med njimi imamo:
-Vodik

-Helija
-Dušik
-Kisik
-Fluor
-Klor
-Neon
-Argon
-Kripton
-Ksenon
To ne pomeni, da drugi elementi ne morejo postati plinasti. Na primer, kovine se lahko spremenijo v pline, če so podvržene višjim temperaturam kot njihove vrelišča. Tako lahko obstajajo plini iz železa, živega srebra, srebra, zlata, bakra, oboda, iridij, delcev Osmio; katere koli kovine.
Plinaste spojine
Na naslednjem seznamu imamo nekaj primerov plinastih spojin:
-Ogljikov monoksid, co
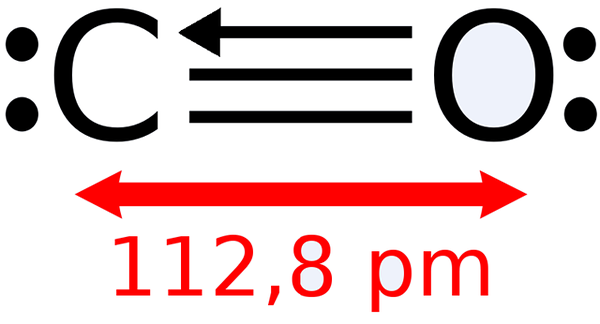 Lewisova struktura ogljikovega monoksida
Lewisova struktura ogljikovega monoksida -Ogljikov dioksid, co2 (plin, ki tvori naše izdihovanje)
-Amoniak, NH3 (vitalna snov za simfine industrijskih procesov)
-Žveplov trioksid, torej3
-Metan, pogl4 (Domači plin, s katerim je kuhana)
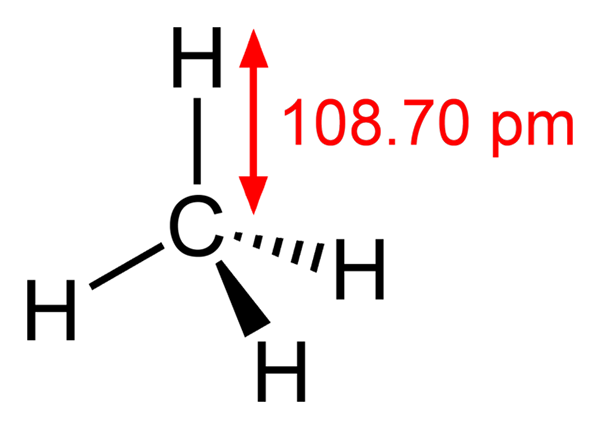 Struktura metana
Struktura metana -Etano, pogl3Pogl3
-Dušikov dioksid, št2 (Rjava obarvana plin)
-Phosgen, COCL2 (zelo strupena snov)
-Zrak (kot mešanica dušika, kisika, argona in drugih plinov)
-Vodna para, h2Ali (ki je del oblakov, geiserjev, strojev vaporizer itd.).
-Acetilen, HC≡CH
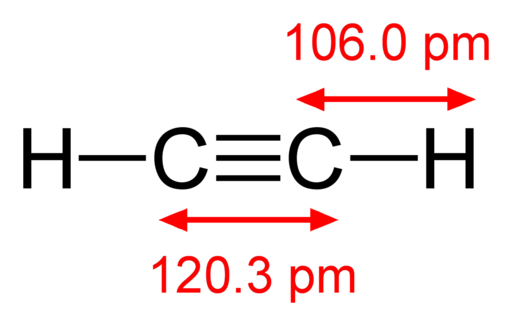 Strukturna formula acetilena
Strukturna formula acetilena -Jodni hlapi, i2 (Vijolični barvni plin)
-Hexafluoruro iz žvepla, SF6 (zelo gost in močan plin)
-Hidrazin, n2H4
-Vodikov klorid, HCl (ki se raztopi v vodi, proizvaja klorovodikovo kislino)
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2020). Plin. Pridobljeno iz: v.Wikipedija.org
- Edward a. Mason. (6. februar 2020). Plin. Encyclopædia Britannica. Okrevano od: Britannica.com
- Čelada, Anne Marie, ph.D. (11. februar 2020). Opredelitev plina in primer v kemiji. Okreval od: Thoughtco.com
- María Estela Raffino. (12. februar 2020). Kaj je plinasto stanje? Okrevano od: koncept.od

