Kovalentna vez
- 1905
- 546
- Ms. Pablo Lebsack
Kaj je kovalentna povezava?
Kovalentna vez je močna interakcija, ki omogoča, da se dva ali več atomov pridružita, da tvorita molekule. To je ena od vrst kemičnih vezi, v katerih nekaj elektronov sodeluje, ki izvirajo iz najbolj zunanjih orbitalov atomov, ki so povezani.
Teoretično vsak atom prispeva enega od dveh elektronov, ko se kovalentno poveže, tako da osvoji stabilnost. Par elektronov, ki postane nekakšen "elektronski kavelj" med dvema atomskima jedroma, se deli med dvema enakima atomama, vendar se to ne zgodi, kadar sta oba atoma dveh različnih elementov.
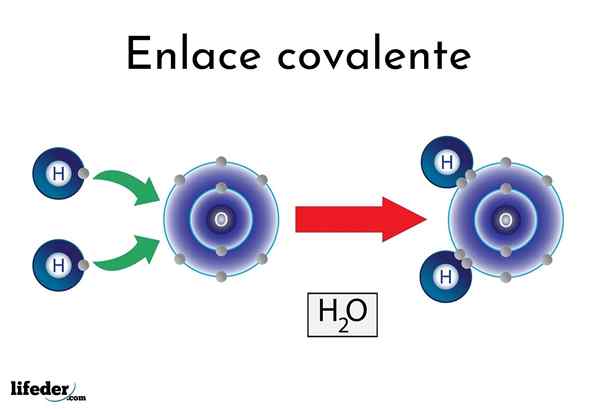
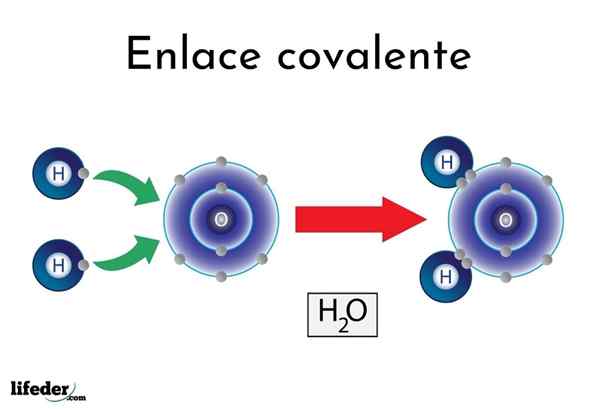 Vodna kovalentna vez
Vodna kovalentna vez Obstajajo atomi ali elementi, ki imajo naravno nagnjenost k dajanju elektronov, drugi pa jih raje osvojijo.
Na primer znana molekula vode, h2Ali ima dve kovalentni povezavi: H-O-H. Vodogeni in kisik imata dva para elektronov, vendar so ta orbita bližje atomu kisika kot vodik. Ta pojav je posledica polarnosti in elektronegativnosti.
Značilnosti kovalentnih vezi
Kovalentne vezi predstavljajo naslednje značilnosti:
-Vključujejo nekaj elektronov za vsako kovalentno vez.
-Njegove dolžine so običajno izražene v enotah PM (picometers) ali Armstrong (Å).
-Težko jih je prekiniti, kar pomeni, da so zelo močni.
-Ko se zlomijo, se pojavijo kemične spremembe ali transformacije, saj molekula izgublja atome. V tem procesu se energija absorbira.
-Ko se oblikujejo, se rodi nova molekula. V tem procesu se energija sprosti.
Lahko vam služi: Kemične reakcije: značilnosti, deli, vrste, primeri-Njegove dolžine se razlikujejo glede na avidnost, ki jo ima eden od povezanih atomov do para elektronov; To pomeni, bolj ko ga privlači, kovalentna povezava se podaljša.
-Najpreprostejše kovalentne vezi obstajajo le med dvema atomama hkrati in so predstavljene s skriptom ali črto (-).
Obstajajo tudi druge funkcije, ki veljajo za bolj zapletene kovalentne povezave, ki pa so tudi v skladu s tem, kar je komentirano zgoraj.
Vrste kovalentnih povezav
Kovalentne vezi lahko načeloma razvrstimo na dva načina: glede na število deljenih elektronov in glede na nastalo polarnost, ko je molekula oblikovana. Oba bosta površno opisana spodaj.
Glede na število skupnih elektronov
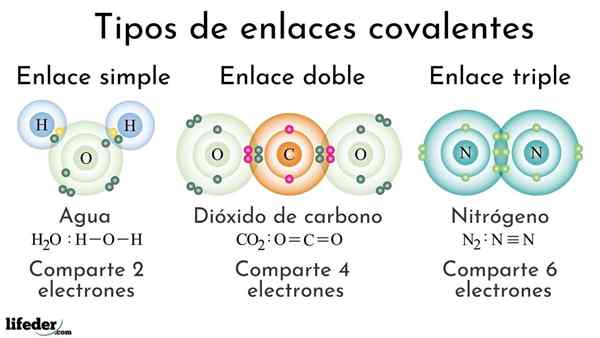 Vrste kovalentnih obveznic glede na število skupnih elektronov
Vrste kovalentnih obveznic glede na število skupnih elektronov Kovalentne obveznice glede na število skupnih elektronov je mogoče razvrstiti kot preproste, dvojne ali trojne. Na zgornji sliki so prikazane te povezave za tri molekule, ki bodo obravnavane spodaj.
-
Preprosto
Preprosta kovalentna vez je ena, v kateri je le nekaj elektronov, torej dva elektrona. Primer te povezave, ki jo vidimo v molekuli vode, h2Tudi. Upoštevajte, da je od vseh kovalentnih vezi, preprost, i-i, najdaljši od vseh. To je skoraj vedno.
-
Dvojno
V dvojni kovalentni vezi imamo, kot že ime pove, dva para elektronov, kar pomeni, da obstajajo štirje elektroni, ki okrepijo "elektronski kavelj" med obema povezanimi atomi.
To pomeni, da je dvojna vez (=) močnejša od preproste (-). Vendar je bolj reaktivna, kar je, čeprav se morda zdi nasprotujoče, enostavno razložiti glede na prekrivanje atomskih orbitalov.
Vam lahko služi: polarnost (kemija): kaj je, definicija, primeriPrimer te povezave je viden v molekuli ogljikovega dioksida, CO2. Dva atoma kisika ostaneta močno združena z ogljikom zahvaljujoč tej vezi, OR = C = O, ki je, ker sta močnejša, bližje atomom; In to vodi do skrajšanja povezave.
-
Trojna
Trojna povezava je najmočnejša in najkrajša kovalentna vez (skupna). Upoštevajte, da za dušikovo molekulo, n2 ali n≡n, njihovi atomi, ki jih predstavljajo modrikaste krogle, so zelo blizu drug drugemu.
V trojni povezavi imamo tri elektronske pare, ki so enaki šestim elektronom, ki krepijo kovalentno vez med obema atomama.
-
Dativ
Povezava Dative je posebna vrsta preproste povezave, ki je sestavljena iz para elektronov, izhaja le iz enega od dveh povezanih atomov. To pomeni, da bi ga lahko videli kot "prisilno skupno rabo".
Na primer molekula M2Ali uporabite enega od parov brez kisika, da jih podarite v ion H+ (H2O: → H+ = [H2O-h]+ ali h3Tudi+).
Glede na polarnost
Kovalentne vezi v skladu s polarnostjo lahko razvrstimo med polarne kovalentne ali ne -polarne kovalentne.
-
Polarne kovalentne vezi
Pojavlja se med dvema različnima atomama, katerih razlika v elektronegativnosti je velika. To ima za posledico tvorbo dipola, kjer se atom negativno koncentrira (privablja elektrone), drugi pa koncenttivno (daje elektrone). Na primer, kovalentna vez HF (H-F) je polarna, ker je fluorid bolj elektronegativen kot vodik.
-
Ne -polarne kovalentne povezave
Pojavi se med dvema enakima atomama, katerih razlika v elektronegativnosti je nič ali zelo majhna. Zgoraj omenjene molekule: i2, Tudi2 in n2 Predstavljajo ne -polarne kovalentne vezi. Zato so elektroni okoli obeh atomov z enako frekvenco.
Lahko vam služi: uretan: struktura, lastnosti, pridobivanje, uporabePrimeri kovalentnih povezav
Končno bodo poleg že pojasnjenih navedenih drugih kovalentnih obveznic, ki kažejo tudi na njihove vrste:
H2S (H-S-H), preprost polarni kovalent | HCl (H-CL), Polarna preprosta kovalentna povezava |
H2 (H-H), ne polarni preprost kovalent | C2H4 (H-C≡C-H), z dvema preprostima polarnima povezavama (C-H) in trojno nepolarno povezavo (C≡C) |
F2 (F-F), preprost nepolarni kovalent | P2 (str≡P), ne -polarna (ali apolarna) kovalentna vez |
Co₂ (o = c = o), dvojni polarni kovalent | S2 (s = s), ne -polarna dvojna kovalentna vez |
HCN (H-C≡N), s preprosto polarno kovalentno vezjo (H-C) in drugo trojno polarno povezavo (c≡N) | NH3 (N-H) s tremi preprostimi polarnimi kovalentnimi vezmi |
Navedeni primeri ustrezajo majhnim molekulam. Toda kovalentne vezi so prisotne v vseh obstoječih molekulah, vključno s polimeri, biomolekulami, makromolekulami, minerali, keramiko, ogljikovodiki.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- María Estela Raffino. (28. junij 2020). Kovalentna vez. Koncept.od. Okrevano od: koncept.od
- Wikipedija. (2020). Kovalentna vez. Pridobljeno iz: v.Wikipedija.org
- Camy Fung & Nima Mirzaee. (15. avgust 2020). Kovalentne obveznice. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (27. avgust 2020). Kaj je kovalentna vez v kemiji? Okreval od: Thoughtco.com

