Ionizacijska energija
- 4480
- 1382
- Cary Goyette
Kaj je ionizacijska energija?
The ionizacijska energija, Zastopana s simbolom I, je najmanjša količina energije, potrebna za zagon zunanjega elektrona do mola atomov v plinastem stanju, v svojem temeljnem stanju. Z drugimi besedami, najmanjša količina energije, potrebna za pretvorbo mola nevtralnih atomov v plinasto stanje v mol ionov s pozitivno obremenitvijo (od tod tudi ime).
Vidna v obliki kemične enačbe bi bila ionizacijska energija energija, potrebna za naslednji postopek:
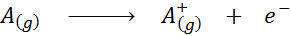
Ionizacijska energija je neposredno merilo, kako močno so povezani najbolj oddaljeni elektroni kemičnega elementa. Pri določanju energije ionizacijskega procesa plinastega stanja se izognemo prispevku ali motenju medmolekulskih interakcij, ki se pojavljajo v tekočem in trdnem stanju.
Na ta način je zagotovljeno, da je ionizacijska energija odvisna le od notranjih sil atoma in zlasti od stabilnosti elektronov, ki tvorijo valenčno plast vsakega elementa.
Postopek odstranjevanja elektrona iz plasti Valencije je postopek, ki zahteva energijo, zato je endotermični postopek. Zaradi tega so ionizacijske energije vedno pozitivne (s konvencijo, ko energija vstopi v sistem, se šteje za pozitivno).
Obstaja več kot ena ionizacijska energija
Čeprav se opredelitev ionizacijske energije uporablja za nevtralne atome, ki postanejo pozitivni ioni (to je kationi.
V tem smislu energija za ionizacijo nevtralnega atoma postane le prva od mnogih možnih ionizacijskih energij, saj obstaja po en za vsak elektron, ki se vrti okoli jedra.
Vam lahko služi: kakšni so elementi gibanja?Z drugimi besedami, energije, povezane z vsemi naslednjimi procesi, veljajo za ionizacijske energije:
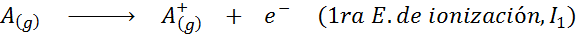
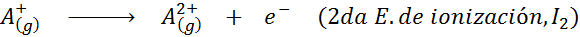
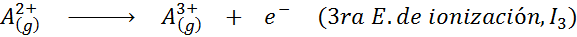
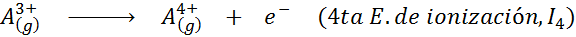
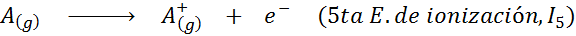
Vrstni red zaporednih ionizacijskih energij
Za kateri koli atom katerega koli elementa je izpolnjeno, da bo ionizacijska energija vedno večja od vseh prejšnjih ionizacijskih energij. Z drugimi besedami, zaporedne ionizacijske energije imajo naslednji odnos:
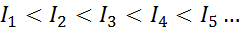
Razlog, zakaj se to zgodi, je zelo preprost. Prva ionizacijska energija vključuje odstranitev elektrona na nevtralni atom. Vendar druga ionizacijska energija pomeni, da je elektron odnesel atomu, ki je že izgubil prvi.
Odsotnost elektrona pušča pozitivno neto obremenitev, ki z večjo močjo privabi preostale elektrone, zato jih je težje začeti. Poleg tega ta odsotnost tudi zmanjšuje učinek ščita, ki ga imajo elektroni na najbolj oddaljene elektrone, zato jih jedra lahko močneje pritegne.
Rezultat tega je, da je težje začeti drugi elektron kot prvi, in težje bo začeti tretji kot drugi, in tako naprej, kot je razvidno iz naslednje tabele ionizacije za prvih 10 elementov tabele periodično.
Z | Element | Najprej | Drugi | Tretjič | Četrtina | Peti | Šesti |
1 | H | 1312 | |||||
2 | On | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Biti | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | Tudi | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | NE | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Periodični trend ionizacijske energije
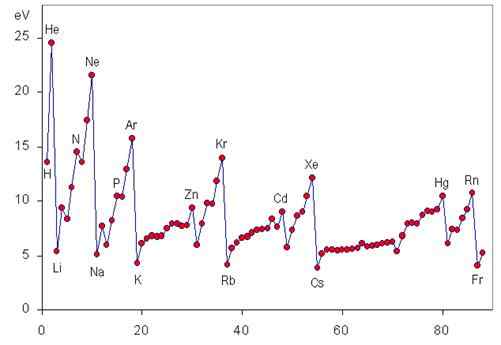
Ionizacijska energija je periodična lastnost, ki se povečuje od leve proti desni in od spodaj na periodično tabelo, kot je razvidno iz naslednje grafike.
Vam lahko služi: linearna dilatacija: kaj je to, formula in koeficienti, primer
Sprememba I v obdobju
Ko se skozi obdobje premikamo od leve proti desni, se nekoliko imenuje učinkovita jedrska obremenitev postopoma, kar ni nič drugega kot resnična pozitivna obremenitev, ki jo lahko "vidijo" zaradi ščita najbolj notranjega elektronov.
To pomeni, da se sila, s katero lahko jedro privabi elektrone Valencije, povečuje, zato jih težje odtrga in zahtevana energija (torej ionizacijska energija) postane večja.
Sprememba I v celotni skupini
Ko se spuščamo v skupino, postavljamo elektrone v povečanje ravni energije in zato v atomske orbitale vse bolj daleč od jedra. Zaradi tega se sila, s katero jedro privlači valenčne elektrone, zmanjšuje, ko se spuščamo v skupino, prav tako zmanjša ionizacijsko energijo.
Kako določiti ionizacijsko energijo?
Ionizacijska energija je eksperimentalno določena količina z vrsto tehnik, imenovanih skupaj s fotoelektronskimi spektroskopiji.
Te tehnike temeljijo na pojavu, ki je zelo podoben fotoelektričnemu učinku, pri katerem je elektromagnetno sevanje sposobno začeti elektrone atoma, razlika med energijo sevanja in kinetično energijo.
Različne tehnike spektroskopije fotoelektronov omogočajo analizo energije, katerih praktično je kateri koli elektron povezan z njegovim jedru, bodisi z elektronom Valencije ali notranjega elektrona.
Primeri ionizacijske energije
Prve ionizacijske energije plemenitih plinov
Plemenite plini imajo najbolj stabilne elektronske konfiguracije vseh elementov periodične tabele. Zaradi tega imajo tudi največje ionizacijske energije. Spodaj je predstavljena prva ionizacijska energija vsakega od plemenitih plinov:
-
Helija
Njegova prva ionizacijska energija je 2373 kJ/mol, najvišja v celotni periodični tabeli.
-
Neon
Njegova prva ionizacijska energija je 2080 kJ/mol in je druga najvišja.
-
Argon
Njegova prva ionizacijska energija je 1521 kJ/mol. Samo F, NE in on ima večje ionizacijske energije.
-
Kripton
Prva ionizacijska energija je 1350 kJ/mol. Ni tako visok kot drugi, vendar je še vedno večji od sosednjih elementov.
-
Ksenon
Enako, kar je rečeno o Kriptonu, lahko rečemo o ksenonu s svojo prvo ionizacijsko energijo 1170 kJ/mol.
Vam lahko služi: luknja za črv: zgodovina, teorija, vrste, tvorbaPrve in druge ionizacijske energije alkalnih kovin
Alkalne kovine imajo posledično najmanjšo prvo ionizacijsko energijo in največjo drugo ionizacijsko energijo vseh elementov:
-
Litij
Njegova prva ionizacijska energija je manj kot četrtina energije He, vendar ima litij največjo drugo ionizacijsko energijo vseh elementov, ki je 7300 kJ/mol.
-
Natrij
Natrij zelo enostavno izgubi svoj prvi elektron, saj pridobi elektronsko konfiguracijo NE, vendar za odpravo drugega elektrona morate dobaviti 4560KJ/mol.
-
Kalij
Prva energija ionizacije kalija je le 418,7 kJ/mol, drugi pa 3052 kJ/mol, kar je precej večje kot pri sosedih.
-
Rubidium
Z ionizacijsko energijo 403 kJ/mol je Rubidio eden od elementov z manj ionizacijske energije. Vendar je druga 2633 kJ/mol.
-
Cezij
Njegova prva ionizacijska energija je le 375 kJ/mol, drugi 2234 kJ/mol.

