Aktivacijska energija

- 3752
- 605
- Barry Ernser
Pojasnjujemo, kakšna je aktivacijska energija, njegova formula, enote, kako se izračuna, in dajemo več primerov
Kaj je aktivacijska energija?
The Aktivacijska energija (Indo) Opredeljeno je kot minimalna energija, potrebna za izvedbo kemične reakcije. Z drugimi besedami, energetska ovira je treba premagati, da lahko reagenti postanejo izdelki.
Aktivacijsko energijo lahko opazimo v akciji v vsakdanjem življenju. Dejansko vsi vemo, da pri odpiranju ključa za prehod v kuhinji ne gori takoj, ko pride v stik z zrakom.
Tako da se začne reakcija zgorevanja, je treba zagotoviti iskrico ali ogenj tekme. Ta iskra ali ta požar predstavlja aktivacijsko energijo reakcije zgorevanja.
Zakaj je potrebna aktivacijska energija?
Da bi razumeli razlog, zakaj reakcije potrebujejo minimalno energijo, je pomembno razumeti, kako se pojavljajo. Da se lahko odzivajo dva atoma ali molekule, se morajo najprej trčiti. Poleg tega morajo to storiti s pravo orientacijo, tako da se lahko oblikujejo nove kemične vezi in se lahko stari ljudje zlomijo.
Kljub temu, da sta obe molekuli usmerjeni drug proti drugemu s popolno orientacijo, to ne zagotavlja, da se daje učinkovit trk zaradi odbojnosti med elektroni površine molekul.
Zaradi tega je potrebno, da molekule poleg pravilne orientacije potujejo tudi z nekaj hitrosti ali z nekaj minimalne kinetične energije, ki zagotavlja, da je trčenje dovolj močno, da se prepreči odboj elektronov.
Ta minimalna kinetična energija, potrebna na mikroskopski ravni.
Vam lahko služi: litijev bromid: struktura, lastnosti, uporabe, tveganjaKaj je razvidno iz energetskega diagrama?
Energetski diagram je grafični prikaz, ki prikazuje, kako se energija reagentov spreminja, ko se spreminjajo v izdelke. V teh diagramih, kot je tisti, predstavljen spodaj, je enostavno videti in razlagati aktivacijsko energijo.

Na tem grafu modra črta prikazuje energijo, ko reakcija napreduje. Tu lahko vidite, da morajo reagenti najprej premagati hrib, da dosežejo prehodno stanje. V nasprotnem primeru bodo vrnjeni v prvotno stanje.
Višina tega hriba je natančno aktivacijska energija. Če je mogoče premagati, je preostanek ceste navzdol in reagenti hitro postanejo izdelki.
Enote za aktiviranje energije
Aktivacijska energija je intenzivna velikost, ki se izraža v energetskih enotah nad maso ali moli. Ker obstajajo različne energetske enote in različne masne enote, lahko aktivacijsko energijo izrazimo v več različnih enotah. Vendar so tisti, ki se najpogosteje uporabljajo v kemiji,:
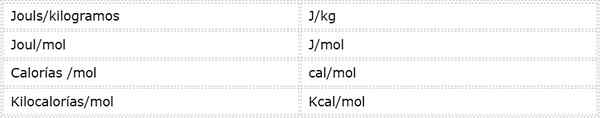
Katera enota se uporablja, je odvisno od podatkov, iz katerih je izračunano, ali uporabe, ki jih bo podana v drugih izračunih.
Formula za aktiviranje energije
Aktivacijska energija je povezana s hitrostjo reakcije. Pravzaprav, večja je aktivacijska energija, nižja je hitrost. To razmerje je matematično izraženo skozi Arrhenijevo enačbo, ki navaja hitrostno konstanto reakcije na temperaturo.
Vam lahko služi: Benedict reagent: za kaj je, komponente, priprave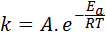
V tej enačbi, k To je hitrostna konstanta reakcije indo To je aktivacijska energija, r je konstanta idealnih plinov, t je absolutna temperatura in se imenuje arrhenius predekponentni faktor, imenovan tudi trčen faktor.
To enačbo je mogoče preurediti tako, da daste:
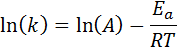
Če je znana vrednost A za reakcijo, lahko aktivirano energijo dobimo s čiščenjem prejšnje enačbe. Vendar to ni način, kako se običajno določi aktivacijska energija reakcije. Običajno se konstanta hitrosti določi pri dveh ali več temperaturah, zaradi česar je nepotrebno vedeti.
Kako se izračuna aktivacijska energija?
Aktivacijska energija se določi iz vrednosti konstante hitrosti pri različnih temperaturah. Vsaj dve vrednosti k merjeno pri različnih vrednostih T za izračun aktivacijske energije, ne da bi vedeli, kar je običajno.
Odvisno od tega, koliko vrednosti k Imajo, lahko izračunate indo Na dva načina:
1. Ko imaš k pri dveh temperaturah
V teh primerih je lažje začeti iz prve oblike Arrhenijeve enačbe. Če pokličemo k1 do hitrosti konstante pri temperaturi T1 in k2 do hitrosti konstante pri temperaturi T2, Potem lahko dvakrat napišemo Arrhenijevo enačbo:
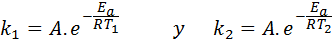
Zdaj lahko poljubno razdelimo katero koli od dveh enačb med drugo, da prekličemo A:
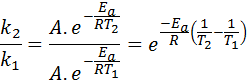
Nato jemanje neperijskega logaritma na obeh straneh in reševanje za Edo, je pridobljeno:
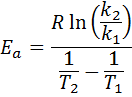
2. Ko imaš k več kot dve temperaturi
V primerih, ko obstaja več določitev konstante hitrosti pri različnih temperaturah, je bolje najti aktivacijsko energijo grafično ali s pomočjo linearne regresije. To temelji na enačbi v logaritmični obliki, ki ima obliko črte:
Lahko vam služi: Clausius-Clapeyronova enačba: za kaj je, primeri, vaje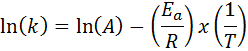
Če naredimo graf Ln (k) v primerjavi (1/t), bomo dobili ravno črto, ki se razreže na osi in v ln (a) in katerih naklon je enak -(edo/R). Od tam dobimo aktivacijsko energijo.
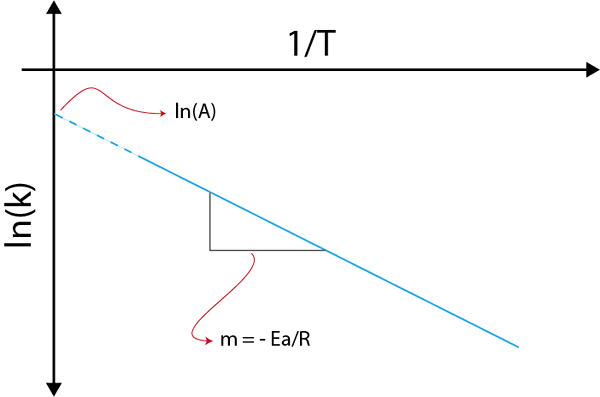 Arrheniusov graf za določitev aktivacijske energije
Arrheniusov graf za določitev aktivacijske energije Primeri izračuna aktivacijskih energij
Primer 1
Hitrostna konstanta reakcije prvega naročila je bila določena pri dveh različnih temperaturah. 298 K je imelo vrednost 0.058 s-1, Medtem ko se je pri 350 K povečala na 0,425 s-1. Določite aktivacijsko energijo te reakcije v j/mol.
- Rešitev: Ker imate konstanto pri dveh temperaturah, lahko zgoraj prikazano zgoraj prikazano aktivacijsko energijo. Ker se energija zahteva v enotah j/mol, moramo v teh enotah uporabiti konstanto plina:
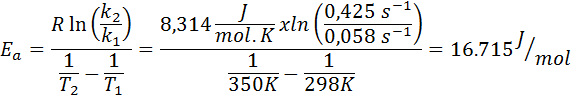
Primer 2
Hitrostna konstanta za sekundo -Kemična reakcija se meri pri različnih temperaturah. Vrednosti so predstavljene v naslednji tabeli. Določite aktivacijsko energijo v kcal/mol.
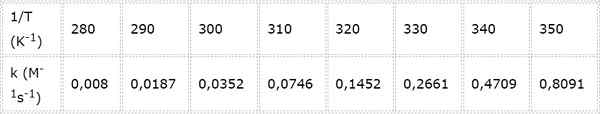
- Rešitev: Kot v tem primeru obstaja več temperatur, je bolje določiti aktivacijsko energijo grafično. Če želite to narediti, je narejen graf Ln (k) vs 1/t, ki je predstavljen spodaj.
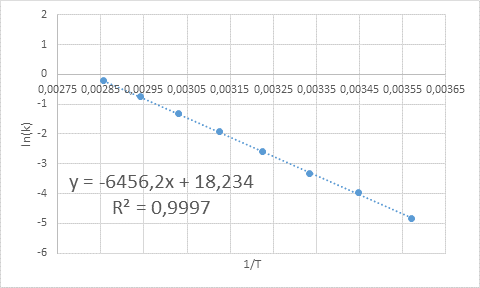 Primer grafične določitve aktivacijske energije
Primer grafične določitve aktivacijske energije Iz enačbe črte, prikazane v grafu, dobimo naklon, ki je -6456.2. Ker je naklon (m) enak - edo/R, potem:
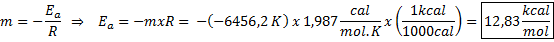
To pomeni, da je aktivacijska energija te reakcije 12,83 kcal/mol.

