Karakteristike referenčnih elektrod, funkcija, primeri
- 3396
- 772
- Don Nitzsche
On Referenčna elektroda To je naprava, ki se uporablja v potenciometrični in voltamétrični analizi za kvantitativno določanje analita. Njegova pomembnost je, kot že ime pove, služiti kot referenca za oceno resnične vrednosti potenciala v reakciji elektrokemičnega pol -vila.
Potenciali pol -media so odvisni od koncentracije iona v interesu, saj reagira z zmago ali izgubo elektronov. Na ta način je mogoče določiti njihovo koncentracijo s temi potenciali. Vendar njihove vrednosti niso absolutne, ampak so povezane s standardno vodikovo elektrodo (ona v angleščini).
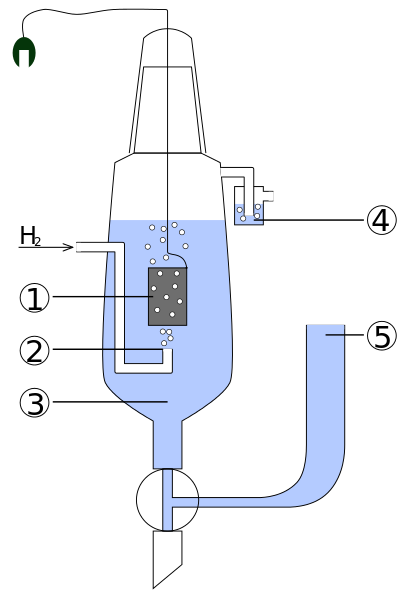
 Diagram delov standardne vodikove elektrote. Vir: standard_hydrogen_electrode.JPG: Kaverinderivevative: Henry Muelpfordt/CC by-S (http: // createCommons.Org/licence/by-sa/3.0/)
Diagram delov standardne vodikove elektrote. Vir: standard_hydrogen_electrode.JPG: Kaverinderivevative: Henry Muelpfordt/CC by-S (http: // createCommons.Org/licence/by-sa/3.0/) Po konvenciji so potenciali vodikovih elektrod enaki 0V. Težava je v tem, da je te elektrode težko manipulirati, zato jih v vseh analizah ni praktično namestiti. Tu vstopijo referenčne elektrode, veliko enostavnejše in katerih potencial se razlikuje od 0V.
Nekatere referenčne elektrode, kot je Calomelova nasičena elektroda (ESC), je mogoče zgraditi v istem laboratoriju, preden se analiza izvede. Prav tako jih na trgu odkrito dobimo s svojimi ustreznimi specifikacijami, tveganja za kontaminiranje vzorca analita pa so minimalna.
[TOC]
Karakteristike referenčnih elektrod
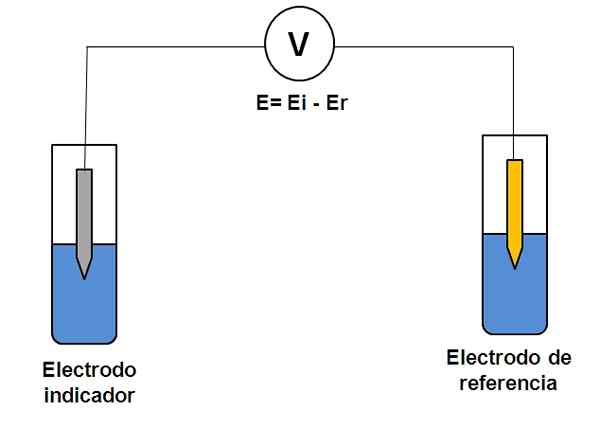 Preprost prikaz sistema dveh elektrod v potenciometriji. Vir: Gabriel Bolívar.
Preprost prikaz sistema dveh elektrod v potenciometriji. Vir: Gabriel Bolívar. Razmislite o dveh sistemu elektrod zgoraj. Eden je indikator (siva), kjer poteka interesna reakcija, druga pa je referenca (zlato). Ta elektrokemijska celica bo imela potencial in, ki bo enak razliki potencialov obeh elektrod (EI-E). Zato mora biti vsaka sprememba E posledica potenciala indikatorske elektrode.
Vam lahko služi: kalijev cianid (KCN): lastnosti, uporabe, strukture, tveganja,Iz zgoraj navedenega je sklenjeno, da ima referenčna elektroda naslednje značilnosti:
-V času ima stabilen potencial in je ponovljiv. To pomeni, da bi moralo biti enako, ne glede na to, kje ali kolikokrat se merijo.
-Njegova kemična sestava je konstantna in neobčutljiva, zato se komajda spreminja, ko deluje z raztopino analita ali se potopi v vodni medij.
-Za razliko od standardne vodikove elektrode je enostavno graditi in namestiti, kar zahteva uporabo vodikovega rezervoarja in povzroči eksplozijska tveganja, ko se vodik meša z zrakom.
Indikatorska elektroda je tista, ki je občutljiva na koncentracijo analita.
Funkcija referenčne elektrode
Referenčne potenciale elektrod se merijo glede na standardno vodikovo elektrodo, zato so njihove vrednosti drugačne od 0V. Zahvaljujoč tem vodikovi elektrodam je možna gradnja standardnih in standardnih potencialnih tabel, ki se pojavljajo v besedilih kemije za redoks reakcije simfine.
Vendar v praksi povsod ne naloži vodikove elektrode. Namesto tega se uporabljajo referenčne elektrode, veliko enostavnejše in varno za manipulacijo.
Ker so njegovi potenciali konstantni in stabilni, so potencialni odčitki elektrokemijske celice izključno posledica indikatorne elektrode; to pomeni za razlike koncentracije zadevnega analita.
Tako je funkcija referenčne elektrode določiti potencial kakršne koli reakcije v enem od pol -limit elektrokemičnega sistema. Če njihovi potenciali ne bi bili stabilni, potem kvantitativne določitve analita ne bi bile zanesljive. Vsaka potenciometrična ali voltametrična analiza mora določiti, katero referenčno elektrodo so uporabili za poročanje o svojih rezultatih.
Lahko vam služi: bromozna kislina (Hbro2): fizikalne in kemijske lastnosti in uporabePrimeri referenčnih elektrod
Na trgu je na voljo več referenčnih elektrod. Nekateri se uporabljajo za zelo specifične določitve. Vendar pa obstajata dve elektrodi med vsemi, ki izstopata zaradi svoje preprostosti in praktičnosti: kalomelna elektroda in srebrni srebrni-clorid, oba zelo ponavljajoča se v številnih potenciometričnih in voltamletričnih analizah.
Kalomelna elektroda
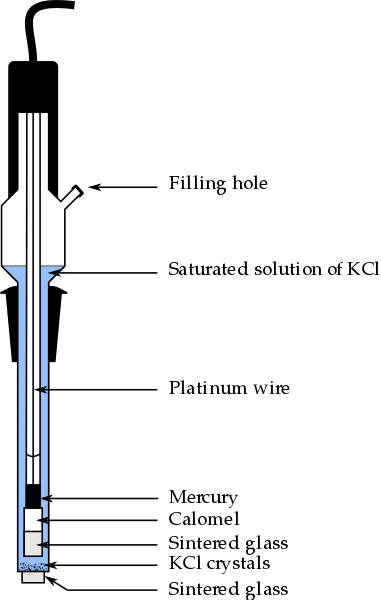 Deli kalomelne elektrode, ena najbolj uporabljenih referenčnih elektrod v analitični kemiji. Vir: Bachi-Bouzouk prek Wikipedije.
Deli kalomelne elektrode, ena najbolj uporabljenih referenčnih elektrod v analitični kemiji. Vir: Bachi-Bouzouk prek Wikipedije. Na zgornji sliki so prikazani običajni deli nasičene kalomelne elektrode, ECS. Govori se, da je nasičen, ker vsebuje nasičeno raztopino KCL (modra), ki predstavlja tudi unwounds of KCL.
Notranji stolpec, ki ga potuje s platinasto žico, je napolnjen z živo srebro, ki v stiku s kalomelno pasto, HG2Cl2 o Merkurski klorid (I) in nasičena raztopina KCL. Tako je v tej elektrodi pomembna koncentracija Cl ionov-, Ker njegova vrednost spremeni potencial elektrode.
Reakcija, ki poteka, je naslednja:
Hg2Cl2(s) + 2e- ⇌ 2HG (L) + 2Cl-
In ima e ° 0.241 V.
Na spodnjem koncu EC je porozno ocvrto, ki se daje v električni stik z raztopino analita in omogoča nadzorovano izmenjavo ionskih ionov-. V nasprotnem primeru bi v vzorcu obstajala kontaminacija kloridov in tudi elektroda bi izgubila dragoceno nasičeno raztopino KCL.
Ta elektroda se uporablja za meritve pH in na splošno pri vsakem analitu, katerega koncentracijo je mogoče določiti v vodnem mediju.
Lahko vam služi: toplotni alkohol: struktura, lastnosti, tveganja in uporabeSrebrna srebrna elektroda
 Srebrno srebrno elektro. Vir: tenofallTrades (pogovor) (nalaganje). / Javna domena
Srebrno srebrno elektro. Vir: tenofallTrades (pogovor) (nalaganje). / Javna domena Podobno kot Calomelova elektroda je tudi srebrna srebrna elektroda sestavljena iz srebrne žice, prekrite s srebrnim kloridom, in tudi potopljeno v raztopino, nasičeno z mešanico KCl in AgCl.
Vsi njegovi deli so zaščiteni v plastični cevi, ki ima porozno odprtino, skozi katero vzpostavi električni stik z raztopino.
Reakcija, ki definira njegov potencial, eº = 0.197 V, je naslednje:
Agcl (s) + e- ⇌ ag (s)+cl-
Ta elektroda predstavlja večje uporabe in preference kot kalomela, kar je posledica negativnega vpliva živega srebra na okolje. Po drugi strani so srebrno trdne srebrne elektrode enostavnejše, varne in poceni za gradnjo v laboratoriju.
Nato pravimo, da srebrno-vijačna elektroda nadomešča Calomel-ove v mnogih svojih aplikacijah (potenciometrične stopnje, korozijske teste, elektrokemijske analize itd.).
To je tudi ena izmed želenih možnosti biologije in medicine, zlasti za elektrokardiografijo in elektroencefalografijo, saj sta srebro ali njihova sol relativno strupene snovi za telo.
Reference
- Dan, r., & Underwood, a. (1965). Kvantitativna analitična kemija. (Peti izd.). Pearson Prentice Hall.
- Skoog d.Do., Zahod d.M. (1986). Instrumentalna analiza. (Drugi izd.). Inter -American., Mehika.
- Wikipedija. (2020). Referenca elektrode. Pridobljeno iz: v.Wikipedija.org
- Elsevier b.V. (2020). Referenca elektrode. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Kemija librettexts. (9. junij 2020). Referenčne elektrode. Okrevano od: kem.Librettexts.org
- « Lokacija, zgodovina, opis, ruševine Alexandria, ruševine
- Emily Dickinson Biografija, dosežki, dela, stavki »

