Struktura žveplovega dioksida (SO2), lastnosti, uporabe, tveganja

- 4813
- 672
- Ms. Pablo Lebsack
On žveplov dioksid To je plinasta anorganska spojina, ki jo tvorita žveplo (S) in kisik (O), saj je njegova kemična formula2. To je brezbarven plin z dražilnim in zadušljivim vonjem. Poleg tega so kislinske raztopine, ki tvorijo vodotopno. Vulkani ga med izbruhi izgnajo proti vzdušju.
Je del biološkega in geokemijskega cikla žvepla, vendar se v velikih količinah proizvaja z nekaterimi človeškimi dejavnostmi, kot sta rafiniranje nafte in gorenje fosilnih goriv (na primer premog ali dizel).
 Žveplov dioksid tako2 izdajo vulkani med izbruhi. Brocken inaglory [cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Žveplov dioksid tako2 izdajo vulkani med izbruhi. Brocken inaglory [cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. SO2 To je reducirajoči agent, ki omogoča, da papirna celuloza ostane bela po pranju denarja z drugimi spojinami. Služi tudi za odpravo ostankov klora v vodi, ki je bila obdelana s tem kemikom.
Uporablja se za ohranjanje nekaterih vrst hrane, razkuženih posod, kjer se pojavi fermentacija grozdnega soka, da pridelajo vino ali ječmen.
Uporablja se tudi kot fungicid v kmetijstvu, za pridobivanje žveplove kisline, kot topilo in kot posrednik v kemičnih reakcijah.
SO2 Prisotna v atmosferi je škodljiva za številne rastline, v vodi, ki jih ribe prizadene in je tudi eden tistih, ki so odgovorni za "kisli dež", ki korodira materiale, ki jih je ustvaril človek.
[TOC]
Struktura
Molekula žveplovega dioksida je simetrična in tvori kot. Kot je zato, ker SO2 Ima nekaj samotnih elektronov, torej elektronov, ki tvorijo povezavo s katerim koli atomom, vendar so brezplačni.
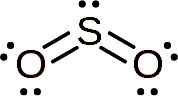 Lewisova struktura žveplovega dioksida, kjer opazimo njegovo kotno obliko in par prostih elektronov. Whittlemario [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Lewisova struktura žveplovega dioksida, kjer opazimo njegovo kotno obliko in par prostih elektronov. Whittlemario [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Nomenklatura
- Žveplov dioksid
- Žveplo anhidrid
- Žveplov oksid.
Lastnosti
Fizično stanje
Brezbarven plin.
Molekularna teža
64,07 g/mol
Tališče
-75,5 ° C
Vrelišče
-10,05 ° C
Gostota
Plin: 2,26 do 0 ° C (glede na zrak, to je gostota zraka = 1). To pomeni, da je težji od zraka.
Tekočina: 1,4 A -10 ° C (glede na vodo, to je gostota vode = 1).
Topnost
Voda topna: 17,7% pri 0 ° C; 11,9% pri 15 ° C; 8,5% pri 25 ° C; 6,4% pri 35 ° C.
Topno v etanolu, dietyl etru, acetonu in kloroformu. Je manj topna v ne -polarnih topilih.
ph
Vodne rešitve SOS2 So kisle.
Kemične lastnosti
SO2 To je močno sredstvo za zmanjšanje in oksidacijo. V prisotnosti zraka in katalizator tako oksidira3.
SW2 + Tudi2 → Torej3
Pari samotnih elektronov se včasih obnaša kot osnova Lewisa, z drugimi besedami, lahko reagira s spojinami, kjer obstaja atom, ki manjka elektrone.
Lahko vam služi: vložitev železa: lastnosti, kako se izdelujejo, strupenost, uporabaČe je tako2 Je v obliki plina in suhe. Če pa je v tekočem ali vlažnem stanju, proizvaja korozijo na te kovine.
SO2 Tekočina z 0,2% vode ali več daje močno železo, medenino in bakreno korozijo. Je jedko za aluminij.
Ko je tekočina, lahko napadete tudi nekaj plastike, gume in premazov.
Vodni SOS SO2
SO2 V vodi je zelo topen. Dolgo je veljalo, da v vodni žveplovi kislini tvori h2SW3, Toda obstoj te kisline ni bil dokazan.
V So rešitvah2 V vodi se pojavijo naslednja stanja:
SW2 + H2Ali ⇔ tako2.H2Tudi
SW2.H2Ali ⇔ hso3- + H3Tudi+
HSo3- + H2Ali ⇔ tako32- + H3Tudi+
Kjer je hso3- To je bisulfitni ion in SO32- To je sulfitni ion. Sulfit ion tako32- Pojavi se predvsem, ko se alkali dodajo v raztopino SO2.
Vodne rešitve SOS2 Imajo zmanjšanje lastnosti, še posebej, če so alkalne.
Druge lastnosti
- Je izjemno stabilen v primerjavi s toploto, celo do 2000 ° C.
- Ni vnetljivo.
Pridobivanje
SO2 Dobimo ga z žveplom zgorevanjem v zraku, čeprav se tvorijo tudi majhne količine SO oblike3.
S + o2 → Torej2
Lahko se med drugim proizvaja tudi s segrevanjem v zraku različnih sulfidov, gorenjem piritskih mineralov in mineralov, ki vsebujejo sulfide.
V primeru železnega pirita, ko oksidiramo železov oksid (III) in SO dobimo2:
4 FES2 + 11 o2 → 2 Vera2Tudi3 + 8 Torej2↑
Prisotnost v naravi
SO2 V ozračje ga sprošča aktivnost vulkanov (9%), vendar izvira tudi iz drugih naravnih dejavnosti (15%) in s človeškimi dejanji (76%).
Eksplozivni vulkanski izbruhi povzročajo znatna letna nihanja ali spremembe2 v ozračju. Ocenjuje se, da je 25% SO2 Vulkani, ki jih oddajajo, opere dež, preden pridejo do stratosfere.
Naravni viri so najpogostejši in so posledica biološkega cikla žvepla.
V mestnih in industrijskih območjih prevladujejo človeški viri. Glavna človeška dejavnost, ki jo proizvaja, je kurjenje fosilnih goriv, kot so premog, bencin in dizel. Drugi človeški viri so rafinerije nafte, kemične rastline in proizvodnja plina.
 Človeške dejavnosti, kot je kurjenje premoga za elektriko, so vir onesnaženja s SO2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Človeške dejavnosti, kot je kurjenje premoga za elektriko, so vir onesnaženja s SO2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Pri sesalcih nastane na endogeni način, torej znotraj telesa živali in ljudi zaradi presnove aminokislin, ki vsebujejo žveplo, zlasti L-cistein.
Vam lahko služi: tekoči elementi: kaj so in primeriPrijave
Pri proizvodnji žveplove kisline
Ena najpomembnejših aplikacij SO2 Je pri pridobivanju žveplove kisline h2SW4.
2 Torej2 + 2 h2Ali + o2 → 2 h2SW4
V predelani prehrambeni industriji
Žveplov dioksid se uporablja kot konzervans in stabilizator hrane, kot sredstvo za nadzor vlage in kot modifikator okusa in teksture nekaterih užitnih izdelkov.
Uporablja se tudi za razkuževanje opreme, ki pride v stik z živili, fermentacijsko opremo, kot so pivovarne in vitalne, zabojnike za hrano itd.
Omogoča ohranjanje sadja in zelenjave, povečuje življenje na polici supermarketa, preprečuje izgubo barve in okusa ter pomoč pri zadrževanju vitamina C (askorbinske kisline) in karotena (predhodniki vitamina A).
 Posušeno sadje ostaja brez gliv in bakterij zahvaljujoč SO2. Avtor: Isabel Ródenas. Vir: Pixabay.com
Posušeno sadje ostaja brez gliv in bakterij zahvaljujoč SO2. Avtor: Isabel Ródenas. Vir: Pixabay.com Služi za ohranjanje vina, ker uničuje bakterije, glive in neželene kvasovke. Uporablja se tudi za sterilizacijo in preprečevanje nastanka nitrozaminov v pivu.
 Fermentacijska oprema ječmena za pridobitev piva sterilizira s SO2. Avtor: Ceridebbie. Vir: Pixabay.
Fermentacijska oprema ječmena za pridobitev piva sterilizira s SO2. Avtor: Ceridebbie. Vir: Pixabay. Uporablja se tudi za namakanje koruznih zrn, beljenje sladkor iz pese in kot protimikrobno proizvodnjo koruznega sirupa z visoko fruktozo.
Kot topilo in reaktivno
Široko se uporablja kot nevodno topilo. Čeprav ne gre za ionizirajoče topilo, je koristno kot topilo brez protonov za nekatere analitične aplikacije in kemične reakcije.
Uporablja se kot topilo in reagent v organskem, posredniku pri proizvodnji drugih spojin, kot so klor dioksid, acetil klorid in v oljni sulfoniranju.
Kot reducirajoč sredstvo
Uporablja se kot reducirajoče sredstvo, čeprav ni tako močan, v alkalni raztopini.
V več aplikacijah
SO2 Uporablja se tudi:
- V kmetijstvu, kot sta fungicid in konzervans v grozdju po obiranju.
- Za izdelavo hidrosulfita.
- Beliti leseno in papirno kašo, saj omogoča stabilizacijo kaše po pranju z vodikovim peroksidom H2Tudi2; SO2 dejanja z uničevanjem h2Tudi2 ostanek in tako ohranite svetlost kaše kot h2Tudi2 lahko povzroči preobrat svetlosti.
- Beliti tekstilna vlakna in pletene članke.
- Za zdravljenje vode odpravlja preostali klor, ki ostane po kloriranju pitne vode, odpadne vode ali industrijskih voda.
- Pri rafiniranju mineralov in kovin kot sredstva za zmanjšanje železa med predelavo mineralov.
- Pri rafiniranju olja za lov kisika in zakasnitve korozije ter kot ekstrakcijsko topilo.
Vam lahko služi: uravnoteženje kemijskih enačb- Kot antioksidant.
- Kot alkalis nevtralizator v proizvodnji stekla.
- V litijevih baterijah kot oksidacijsko sredstvo.
Učinki SO2 endogeni
Nekatere študije so pokazale, da je SO2 Endogeni ali proizveden zaradi samega organizma koristno vpliva na kardiovaskularni sistem, vključno z regulacijo funkcije srca in sprostitvijo krvnih žil.
Ko se SO pojavi v organizmu2 Postane njegov derivati bisulfit hso3- in sulfit tako32-, ki izvaja vazorelajadorski učinek arterij.
SO2 Endogeni zmanjšuje hipertenzijo, preprečuje razvoj ateroskleroze in ščiti srce škode miokarda. Prav tako izvaja antioksidativno delovanje, zavira vnetje in apoptozo (programirana celična smrt).
Zaradi teh razlogov se misli, da je lahko nova terapija za srčno -žilne bolezni.
 Srce lahko koristi od SO2 ki ga proizvaja organizem. Avtor: OpenCLIPART-VEKTORJI. Vir: Pixabay.
Srce lahko koristi od SO2 ki ga proizvaja organizem. Avtor: OpenCLIPART-VEKTORJI. Vir: Pixabay. Tveganja
- Izpostavljenost SO2 Plini lahko privedejo do opeklin v očeh, koži, grlu in sluznici, poškodbah bronhijev in pljuč.
- Nekatere študije poročajo, da ima potencialno tveganje za poškodbe genetskega materiala sesalcev in človeških celic.
- Je jedko. Ni vnetljivo.
Ekotoksičnost
Žveplov dioksid je najpogostejši plin onesnaževal v ozračju, zlasti v mestnih in industrijskih območjih.
Njegova prisotnost v atmosferi prispeva k tako imenovanemu "kislemu dežju", ki je škodljiv za vodne organizme, ribe, vegetacijo in korozijo do materialov, ki jih je ustvaril človek.
 Spomenik, poškodovan zaradi kislega dežja. Nino Barbieri [CC by-S (http: // createCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons.
Spomenik, poškodovan zaradi kislega dežja. Nino Barbieri [CC by-S (http: // createCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons. SO2 To je strupeno za ribe. Zelene rastline so izjemno občutljive2 atmosfersko. Lucerna, bombaž, ječmen in pšenica so poškodovani z nizko okolje, medtem ko so krompir, čebula in koruza veliko bolj odporni.
Učinki zaužitja s hrano
Čeprav je zdrave ljudi neškodljivo, če se uporabljajo v koncentracijah, ki jih priporočajo pooblaščene zdravstvene agencije2 lahko povzroči astmo občutljivim ljudem, ki jo zaužijejo s hrano.
 Občutljivi ljudje lahko trpijo zaradi astme z zaužitjem hrane z majhnimi količinami2. Suraj v Malayalam Wikipedia [javna domena]. Vir: Wikimedia Commons.
Občutljivi ljudje lahko trpijo zaradi astme z zaužitjem hrane z majhnimi količinami2. Suraj v Malayalam Wikipedia [javna domena]. Vir: Wikimedia Commons. Živila, ki jo običajno vsebujejo, so suho sadje, umetna brezalkoholna pijača in alkoholne pijače.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Dioksidni žveplo. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Huang in. et al. (2016). Endogeni žveplovi dioksid: Nova mehka družina bentransmiter v kardiovaskularnem sistemu. Oksidna med celica Longev. 2016; 2016: 8961951. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Windholz, m. et al. (uredniki) (1983). Indeks Merck. Enklopedija kemikalij, zdravil in bioloških. Deseta izdaja. Merck & co., Inc.
- Kruh, x. (2011). Oksidi žveplo: viri, izpostavljenosti in učinki na zdravje. Zdravstveni učinki žveplovih oksidov. V enciklopediji okoljskega zdravja. Okrevano od Scientirect.com.
- Tricker, R. in trik, s. (1999). Onesnaževala in onesnaževala. Žveplov dioksid. V okoljskih zahtevah za elektromehansko in elektronsko opremo. Okrevano od Scientirect.com.
- Bleam, W. (2017). Kemija s kislinsko bazo. Oksidi žveplo. V tleh in okoljski kemiji (druga izdaja). Okrevano od Scientirect.com.
- Freedman, b.J. (1980). Žveplov dioksid v živilih in pijačah: njegova uporaba konzervans in njen vpliv na astmo. Br j dis prsni koš. 1980; 14 (2): 128–34. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Craig, k. (2018). Pregled kemije, uporabe pesticidov in okoljske usode žveplovega dioksida, kot se uporablja v Kaliforniji. V pregledih kontaminacije na okolje in toksikologije. Zvezek 246. Povezava je bila obnovljena.Springer.com.
- « Struktura Silicon nitruro (Si3n4), lastnosti, pridobivanje, uporabe
- Aluminijeva struktura polilorida, lastnosti, pridobivanje, uporabe »

