Zunanja elektronska konfiguracija
- 4526
- 1467
- Mr. Shane Larkin
 Elektronske orbitale. Vir: Patricia.Fidi, Wikimedia Commons
Elektronske orbitale. Vir: Patricia.Fidi, Wikimedia Commons Kaj je zunanja elektronska konfiguracija?
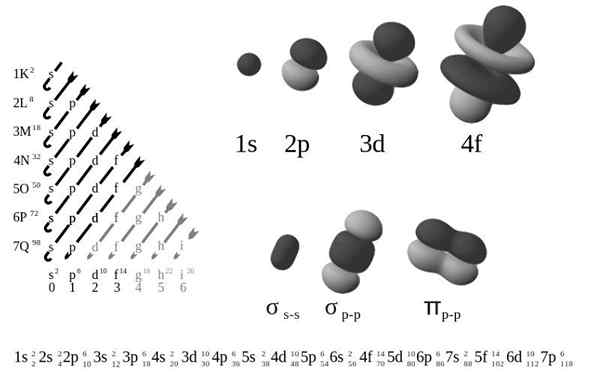
The Zunanja elektronska konfiguracija, Imenovana tudi elektronska struktura, to je razporeditev elektronov na ravneh in pod -ravni energije okoli atomskega jedra. Ravni so od 1 do 7, višine pa so s, p, d in f.
Po Bohrjevem starem atomskem modelu elektroni zasedajo več nivojev v orbiti okoli.
V smislu bolj rafiniranega kvantno mehanskega modela so plasti K-Q razdeljene na niz orbitalov, od katerih je vsak mogoče zasesti največ nekaj elektronov.
Običajno se elektronska konfiguracija uporablja za opisovanje orbitalov atoma v svojem temeljnem stanju, vendar jo lahko uporabimo tudi za predstavljanje atoma, ki je bil ioniziran v kationu ali anionu, ki kompenzira z izgubo ali pridobivanjem elektronov v njihovih orbitalih.
Številne fizikalne in kemijske lastnosti elementov je mogoče povezati z njihovimi edinstvenimi elektronskimi konfiguracijami. Valencia Electrons, elektroni v najbolj oddaljenem sloju, so odločilni dejavnik za edinstveno kemijo elementa.
Osnovni koncepti elektronskih konfiguracij
Preden orbitali dodelite elektrone atoma, se je treba seznaniti z osnovnimi koncepti elektronskih konfiguracij. Vsak element periodične tabele je sestavljen iz atomov, ki so sestavljeni iz protonov, nevtronov in elektronov.
Elektroni imajo negativno obremenitev in so okoli jedra atoma v elektronskih orbitalih, opredeljenih kot prostornina prostora, v katerem je mogoče najti elektron v 95 -odstotni verjetnosti.
Štiri različne vrste orbital (S, P, D in F) imajo različne načine, orbital pa lahko vsebuje največ dva elektrona. Orbitals P, D in F imajo različne pod -ravni, tako da lahko vsebujejo več elektronov.
Vam lahko služi: batch reaktor: značilnosti, deli, aplikacijeKot je navedeno, je elektronska konfiguracija vsakega elementa edinstvena za svoj položaj v periodični tabeli. Raven energije je določena z obdobjem, število elektronov pa daje atomsko število elementa.
Orbitale na različnih ravneh energije so podobne drug drugemu, vendar zavzemajo različna območja v vesolju.
Orbitalna in orbitalna 2s imata značilnosti orbitalnega S (radijske vozlišča, verjetnosti sferične volumna, lahko vsebujejo samo dva elektrona itd.). Toda tako kot na različnih ravneh energije zasedajo različne prostore okoli jedra. Vsak orbital je v periodični tabeli predstavljen s posebnimi bloki.
S blok je območje alkalnih kovin, vključno s helijem (skupini 1 in 2), blok D so prehodne kovine (skupine 3 do 12), blok P so elementi glavne skupine skupin 13 A 18 in blok F so serija lantanidov in aktinidov.
Načelo Aufbau
Aufbau prihaja iz nemške besede Aufbauen, Kaj pomeni "graditi". V bistvu pri pisanju konfiguracij elektronov gradimo elektronske orbitale, ko napredujemo iz enega atoma v drugega.
Ko zapišemo elektronsko konfiguracijo atoma, bomo orbitale napolnili v naraščajočem vrstnem redu atomskega števila.
Načelo Aufbau izvira iz načela izključitve Paulija, ki pravi, da v atomu ni dveh fermionov (na primer elektronov). Imajo lahko enak nabor kvantnih števil, zato se morajo "kopičiti" pri višji ravni energije.
Način, kako se elektroni nabirajo, je težava s konfiguracijo elektronov.
Stabilni atomi imajo toliko elektronov, kot to počnejo protoni v jedru. Elektroni se srečujejo okoli jedra v kvantnih orbitalih po štirih osnovnih pravilih, imenovanih načelo Aufbau.
Vam lahko služi: barijev klorid (bacl2)1. V atomu, ki si jih delita enaka štiri kvantne številke N, L, M in S.
2. Elektroni bodo najprej zasedli orbitale najnižje ravni energije.
3. Elektroni bodo orbitale vedno napolnili z isto vrtečo številko. Ko so orbitale polne, se bo začelo.
4. Elektroni bodo napolnili orbitale za vsoto kvantnih števil n in l. Orbitale z enakimi vrednostmi (n + l) bodo najprej napolnjene z nižjimi N vrednostmi.
Drugo in četrto pravilo sta v bistvu enaka. Primer štirih pravil bi bila orbitala 2p in 3s.
Orbitalna 2p je n = 2 in l = 2 in a 3s orbitala je n = 3 in l = 1. (N + l) = 4 v obeh primerih, vendar ima 2P orbital najnižjo energijo ali nižjo vrednost in bo napolnjena pred plastjo 3S.
Na srečo lahko uporabite Moellerjev diagram, prikazan za polnjenje elektronov. Graf se bere tako, da izvedemo diagonale iz 1S.
 Moeller diagram. Vir: Gabriel Bolívar
Moeller diagram. Vir: Gabriel Bolívar Zdaj, ko je znano, da je vrstni red orbital napolnjen.
Orbitale imajo 1 možno vrednost ml Vsebovati 2 elektrona
P orbitale imajo 3 možne vrednosti ml Vsebovati 6 elektronov
Orbitale imajo 5 možnih vrednosti ml Vsebovati 10 elektronov
F orbitale imajo 7 možnih vrednostil Vsebovati 14 elektronov
To je vse, kar je potrebno za določitev elektronske konfiguracije stabilnega atoma elementa.
Na primer, vzemite element dušika. Dušik ima sedem protonov in torej sedem elektronov. Prva orbitala, ki jo je treba izpolniti, je orbital 1s.
Orbital S ima dva elektrona, zato je ostalo še pet elektronov. Naslednja orbitala je 2S orbitala in vsebuje naslednja dva. Trije končni elektroni bodo odšli v orbitalo 2P, ki lahko vsebuje do šest elektronov.
Vam lahko postreže: karboksimetilcelulozaPomen zunanje elektronske konfiguracije
Konfiguracije elektronov igrajo pomembno vlogo pri določanju lastnosti atoma.
Vsi atomi iste skupine imajo enako zunanjo elektronsko konfiguracijo z izjemo atomske številke N, zato imajo podobne kemijske lastnosti.
Nekateri ključni dejavniki, ki vplivajo na atomske lastnosti, vključujejo velikost največjih okupiranih orbital, energijo najbolj energetskih orbitalov, število orbitalnih prostih mest in število elektronov v orbitalih večje energije.
Večina atomskih lastnosti je lahko povezana s stopnjo privlačnosti med elektroni, ki so zunaj.
Elektroni zunanje plasti so tisti, ki lahko tvorijo kovalentne kemične vezi, ki lahko ion oblikujejo katione ali anione, in tiste, ki dajejo stanje oksidacije kemičnim elementom.
Določili bodo tudi atomski polmer. Ko n postane večji, se atomski polmer poveča. Ko atom izgubi elektron, bo prišlo do krčenja atomskega polmera zaradi zmanjšanja negativne obremenitve okoli jedra.
Elektroni zunanje plasti upoštevajo teorija povezav Valencia, teorijo kristalnega polja in molekulske orbitalne teorije, da dobijo lastnosti molekul in hibridizacije vezi.
Reference
- Aufbau Main. Kem je okreval.Librettexts.org.
- Bozeman Science. Konfiguracija elektronov. Okreval z YouTuba.com.
- Konfiguracije elektronov in lastnosti atomov. Opomogel od enetonte.Edu.

