Organske spojine

- 1985
- 154
- Raymond Moen
Pojasnjujemo, kaj so organske spojine, njihove značilnosti, vrste, ki so, razlike z anorganskimi spojinami in dajejo več primerov
 Organske spojine prihajajo iz živih bitij
Organske spojine prihajajo iz živih bitij Kaj so organske spojine?
The Organske spojine So tisti, ki prihajajo iz živih bitij in vsebujejo atome ogljika in vodika, povezane med seboj v obliki odprtih verig ali zaprtih ciklov.
Poleg ogljika in vodika lahko organske spojine vsebujejo tudi druge elemente, kot so kisik (O), dušik (N), žveplo (S), fosfor (P), fluor (F), klor (CL), bromin (BR) ali jod (i). Vse to se imenuje Heteroátomos.
Življenje ne bi bilo mogoče brez organskih spojin, zato jih vsebujejo vsa živa bitja. Teh snovi je na tisoče in jih lahko najdemo povsod, začenši z lastnimi telesi.
Značilnosti organskih spojin
Temeljijo na kemiji ogljika
Ogljik je osnova vseh organskih spojin. V teh spojinah lahko ogljikove atome povežemo med seboj ali z drugimi elementi. Vsak atom ogljika vedno tvori skupno 4 vezi, med preprostimi, dvojnimi in trojnimi vezmi.
Imajo kovalentne povezave
Obstajajo tri vrste glavnih kemičnih povezav, ki so kovalentna, ionska in kovinska vez. Za organske spojine je značilno, da imajo med vsemi njihovimi atomi le kovalentne vezi.
So goriva
 Carbon je gorivo, ki ga dobimo iz organskih spojin, prisotnih v lesu
Carbon je gorivo, ki ga dobimo iz organskih spojin, prisotnih v lesu Z vsebuje toliko ogljikovih atomov, so organske spojine vnetljive. To pomeni, da lahko gorijo z reakcijo zgorevanja s kisikom zraka.
Reakcije zgorevanja organskih spojin so eksotermične reakcije, ki sproščajo zelo toploto. Vsa živa bitja izkoristijo vso to energijo, da izvedejo vse reakcije, ki nas ohranjajo pri življenju.
Imajo izomerijo
Številne organske spojine imajo enako molekularno formulo, vendar so popolnoma različne spojine. Ta lastnost se imenuje Isomeía in je značilna za organske spojine.
Na primer, oba metilični etanol etanol imata molekularno formulo C2H6Ali, toda prvi je plin, medtem ko je druga tekočina.
Lahko tvorijo polimere
Druga značilnost organskih spojin je, da lahko tvorijo velikanske molekule, ki znova in znova ponavljajo skupino atomov v dolgi verigi. Te spojine se imenujejo polimeri, tipičen primer pa je plastika.
Topnost
Druga lastnost, ki označuje organske spojine, je njihova topnost. Mnoge od njih, zlasti polarnih organskih spojin, so topne v vodi. Druge spojine se ne raztopijo v vodi, ampak v organskih topilih, kot je cikloheksan.
Vam lahko služi: sukcinska kislina: struktura, lastnosti, pridobivanje, uporabeVrste organskih spojin
Organske spojine imajo lastnosti in značilnosti, zaradi katerih se zelo razlikujejo od anorganskih spojin (tiste, ki ne prihajajo iz živih bitij, kot so minerali).
Mnoge od teh značilnosti jim omogočajo, da jih razvrstijo na različne načine, kar povzroča različne vrste organskih spojin. Najpomembnejša merila klasifikacije so:
- Glede na svoj izvor.
- Glede na svojo strukturo in sestavo.
- Glede na funkcionalno skupino.
- Glede na njegovo polarnost.
Nato so opisane vrste organskih spojin, razvrščenih po vsakem od teh meril:
Vrste organskih spojin glede na njihov izvor
Če prihajajo, so lahko organske spojine:
- Naravne organske spojine: To so tisti, ki jih najdemo v naravi in prihajajo neposredno iz živih bitij. Celuloza je dober primer, saj je najbolj obilna naravna organska spojina na zemlji.
- Sintetične organske spojine: Nanašajo se na tiste organske spojine, ki jih kemikalije sintetizirajo v laboratoriju ali v kemični elektrarni. Vsa plastika, ki jo uporabljamo vsak dan, so sintetični in tudi veliko zdravil.
Vrste organskih spojin glede na njihovo strukturo in sestavo
Glede na atome, ki jih sestavljajo, in način, kako se ti atomi združijo, so lahko organske spojine:
- Alifatski ogljikovodiki: Nastavljen samo z ogljikom in vodikom in kjer ogljikove verige tvorijo odprte verige linearne ali razvejane. Vključujejo alquenos in alkines.
- Aromatični ogljikovodiki: Spojine, ki pripadajo tej družini, imenovane tudi Sands, vsebujejo nenasičene cikle (ki ima še vedno več vodika), ki imajo veliko molekularno stabilnost. Ta lastnost se imenuje aromatičnost in je značilna za benzen in vse njene derivate.
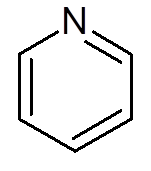
- Heterociklične spojine: To so ciklične spojine, v katerih eno ali več ogljikovih atomov nadomesti heteroátomo, ki je lahko kisik, dušik, žveplo ali fosfor. Primeri heterociklov sta piridin in furano.
- Organometalne spojine: So poseben razred spojin, ki so na pol poti med organskimi in anorganskimi. Za njih je značilno, da vsebujejo organski del s heteroátom.
Vrste organskih spojin v skladu s funkcionalno skupino
Del organske molekule, kjer se običajno pojavljajo kemične reakcije, je majhna skupina atomov, imenovanih funkcionalna skupina. Obstaja več različnih funkcionalnih skupin, ki omogočajo razvrščanje organskih spojin v:
- Zapre: Vsebujejo samo ogljik in vodik, povezani le s preprostimi vezmi. Na primer butana.
- Alkeni: So ogljikovodiki, ki vsebujejo dvojno ogljično-ogljikovo vez. Na primer buutene.
- Alkynes: To so ogljikovodiki, ki vsebujejo trojno ogljično-ogljikovo vez. Na primer, Etino, znan tudi kot acetilen.
- Alkil halogenuros: Organske spojine, ki vsebujejo halogen (F, CL, BR ali I), povezane z alifatskim ogljikom. Na primer klorometan.
- Alkoholi: Alkoholi so polarne organske spojine, ki vsebujejo hidroksilno skupino (-OH) skupaj z alifatskim ogljikom.
- Fenoli: Te spojine vsebujejo tudi hidroksilno skupino (-OH), v tem primeru pa skupaj z aromatičnim ogljikom.
- Ethers: Z lahkoto so prepoznani, saj sta dve verigi karbonov skupaj z atomom kisika. Na primer metilni eter.
- Amine: So organske spojine, ki izhajajo iz amoniaka (NH3). Vsebujejo enega ali več alifatskih ogljikov (alkilnih skupin), povezanih z atomom dušika s pomočjo preprostih vezi.
- Aldehidi: Oksigenirane organske spojine, ki vsebujejo karbonilno skupino (C = O), skupaj z vodikom v enem od svojih končnih ogljikov. Na splošno imajo značilne vonjave, kot je cimaldehid, ki daje vonj cimeta.
- Ketoni: So kisikove organske spojine, ki vsebujejo karbonilno skupino (C = O) skupaj z dvema ogljikovima verigama.
- Karboksilne kisline: Imenujejo se tudi organske kisline, so šibke kisline, ki vsebujejo karboksilno skupino (-COOH) v enem od njegovih končnih ogljikov.
- Estri: Prihajajo iz zveze karboksilne kisline z alkoholom. V tem primeru vodik karboksilne skupine nadomesti najemna skupina.
- Amidas: Prihajajo iz zveze karboksilne kisline z aminom. V tem primeru je OH karboksilne skupine nadomeščen z dušikom, pritrjenim na dva vodika, vodik in alkil ali dva alkala.
Vrste organskih spojin glede na njihovo polarnost
Organske spojine lahko razvrstimo tudi v polarno in apolarno:
- Polarne organske spojine: Te spojine imajo polarne kovalentne vezi z atomi, kot sta dušik in kisik, ki naredijo celotno molekulo polarno. Večina teh spojin je topna v vodi.
- Apolarne organske spojine: To so tisti, ki nimajo polarnih povezav ali se polarnosti njihovih povezav prekličejo. Te spojine niso topne v vodi.
Razlike med organskimi spojinami in anorganskimi spojinami
Naslednja tabela povzema razlike med organskimi in anorganskimi spojinami:
Organske spojine | Anorganske spojine | |
Izvor: | Prihajajo iz živih bitij ali njihovih ostankov. | Ne prihajajo od živih bitij. |
Kompozicija: | Tvori skoraj izključno C, N, O, S, P, F, CL, BR in I. | Lahko jih oblikujejo kateri koli element periodične tabele. |
Vrste povezav: | Tvorijo kovalentne vezi tako polarne kot apolarne. | Lahko tvorijo vse vrste kemičnih povezav, vključno s polarnimi, apolarnimi, ionskimi ali kovinskimi kovalentnimi vezmi. |
Izomery: | Večina prisotnih Isomeía. | Samo nekateri prisotni Isomeía. |
Goriva: | So goriva. | Večina ni vnetljiva. |
Primeri organskih spojin
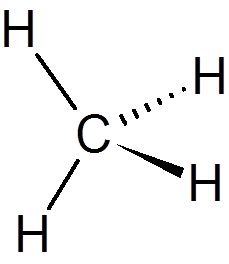
1. Metan (pogl4)
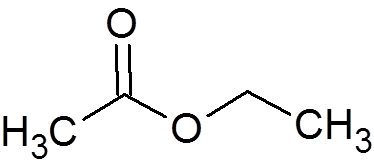
2. Etil acetat (c4H8Tudi2)
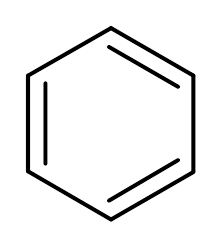
3. Benzen (c6H6)
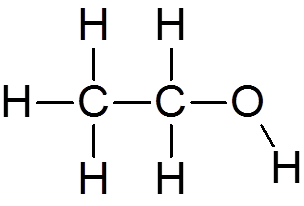
4. Etilni alkohol (c2H6Da)
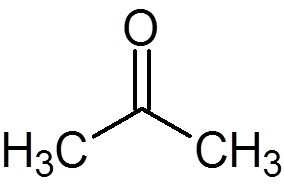
5. Aceton (c3H6Da)
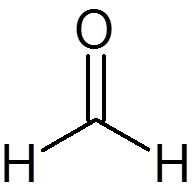
6. Formaldehid (pogl2Da)
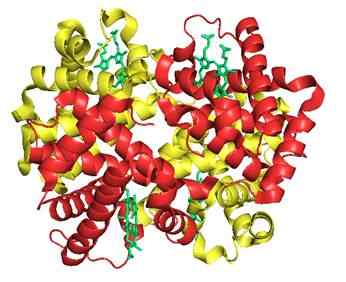
7. Hemoglobin (beljakovina)
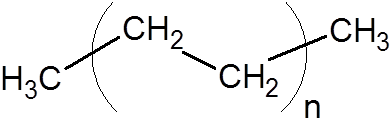
8. Polietilen (ena najpogostejših plastike)
9. Glukoza (c6H12Tudi6)
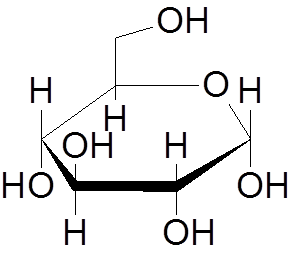
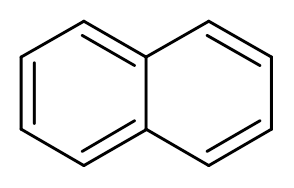
10. Naftalen (c10H8)
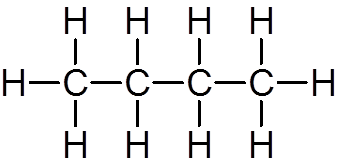
enajst. Butano (c4H10)
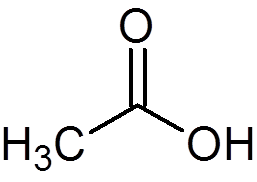
12. Ocetna kislina ali kis (c2H4Tudi2)
13. Neopentano (c5H12)
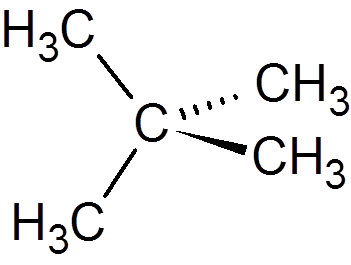
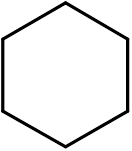
14. Cikloheksan (c6H12)
petnajst. Piridin (c5H5N)
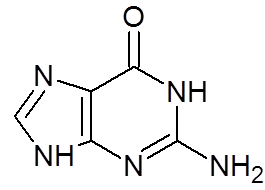
16. Guanina (c5H5N5Da)
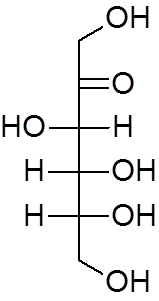
17. Fruktoza (c6H12Tudi6)
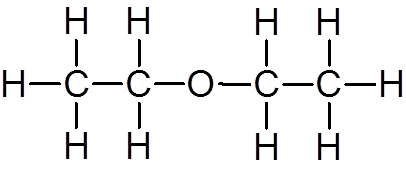
18. Etilni eter (c4H10Da)
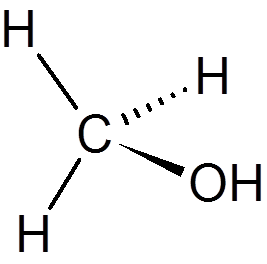
19. Metanol (pogl4Da)
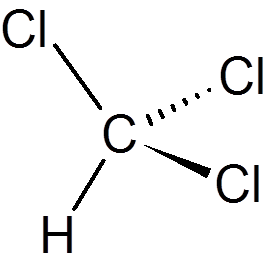
dvajset. Kloroform (chcl3)
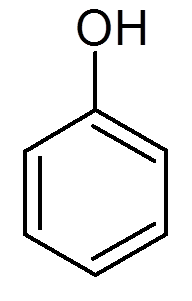
enaindvajset. Fenol (c6H6Da)
22. Acetilen (c2H2)
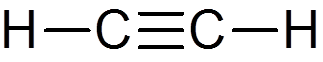
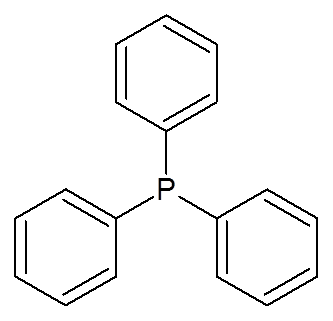
23. Trifenilfosfin ((c6H6)3P)
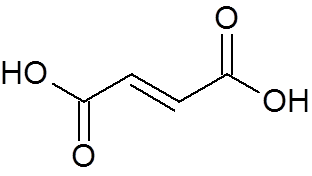
24. 24. Trans-buteodionska kislina (c4H4Tudi4)
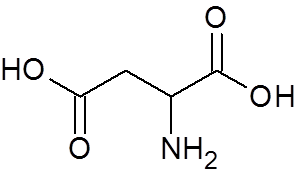
25. Aspartinska kislina (aminokislina) (c4H7Ne4)
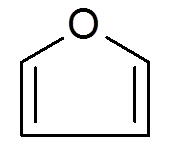
26. Furano (c4H4Da)
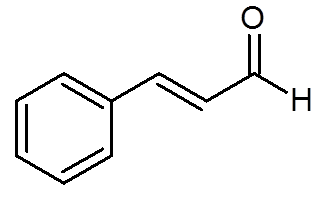
27. Cimaldehid (aroma cimeta) (c9H8Da)
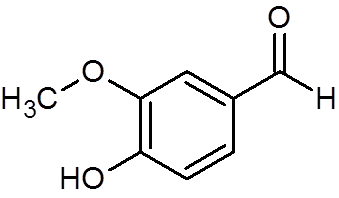
28. Vanilin (c8H8Tudi3)
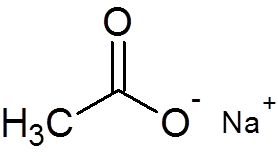
29. Natrijev acetat (c2H3Tudi2Na)
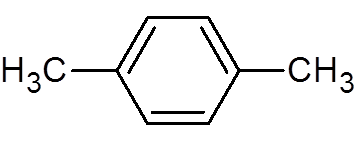
30. P-ksilen (c8H10)
Reference
- Carey, f., & Giuliano, r. (2013). Organska kemija, 9. izdaja (9. izd.). New York City, New York: McGraw-Hill Education.
- Grad a., M. G. (s.F.). Glavni razredi organskih spojin in funkcionalnih skupin. Okreval od UAEH.Edu.mx
- Chang, R., & Goldsby, k. Do. (2012). Kemija, 11. izdaja (11. izd.). New York City, New York: McGraw-Hill Education.
- Klein, d. R. (2011). Organska kemija (1.do Ed.). Hoboken, New Jersey: Wiley.
- Morrison, r. T., & Boyd, r. N. (2003). Organska kemija (6. izd.). Boston, Massachusetts: Allyn & Bacon.

