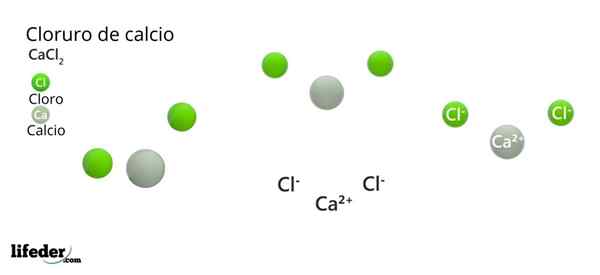
Kalcijev klorid (CACL2)
- 3317
- 1040
- Cary Goyette
Pojasnjujemo, kaj kalcijev klorid, njegova struktura, fizikalne in kemijske lastnosti, kako se sintetizira in njene uporabe so
Kaj je kalcijev klorid?
On Kalcijev klorid (Cacl2) Je anorganska sol, sestavljena iz kalcija, alkalne kovine in halogenskega klora. V tej sestavi je več elektrostatičnih interakcij, ki opredeljujejo zunanji videz njihovih kristalov in preostanek njegovih fizikalnih lastnosti.
Spremljajo ga tudi molekule vode, ki tvorijo Hydrates splošne formule COCL2· XH2Ali z x = 0, 1, 2, 4 in 6. Ko je x = 0, soli primanjkuje vode in je anhidrid, kot je navedeno z zgoraj omenjeno kemijsko formulo.
Na vrhunski sliki je prikazano nekaj trdnih delov CACL2. V pogojih majhne vlažnosti je to mogoče.
Formula
Njegova kemična formula je Cacl2: To izraža za vsak Ca ion2+ Obstajata dva iona CL- ki nevtralizira pozitivno obremenitev. Kalcijeva kovina -skupina 2 periodične tabele (SR. Scholambara)- daje dva elektrona na vsak atom klora, skupinski element 17.
Struktura kalcijevega klorida
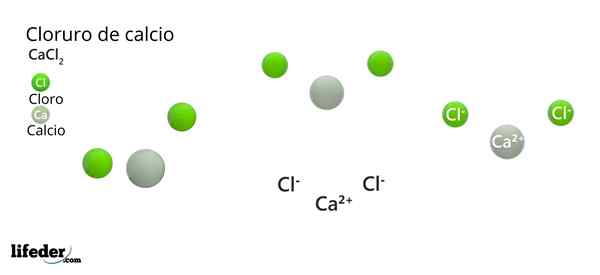
Na vrhunski sliki je ponazorjena struktura Cacl2 anhidrid. Zelene sfere ustrezajo ionom CL-, medtem ko bela do ionov ca2+. Te kroglice so pritrjene v vzporednici, kar ni nič drugega kot enotna ortrorombična celica kristalov.
Struktura lahko daje lažno idejo, da prevladuje kalcij; Če pa se reproducira več ponovitev enote celice-.
Po drugi strani pa ioni CA2+ Imajo manjše ionske radijske sprejemnike kot Cl ioni-. To je zato, ker, ko izgubijo elektrone, imajo jedra atomov večjo privlačno silo na zunanjih elektronskih plasteh, kar zmanjšuje ionski polmer.
V primeru CL-, Ta ima dodaten elektron, ki ga ne more pritegniti iste sile, s čimer se poveča njen ionski polmer.
Vam lahko služi: vodne rešitveMolekularna geometrija in vodni kalcijevi kompleksi
V središču paralelepipipa2+ Obkrožen je s šestimi cl-. Štirje od teh ležijo v kvadratni ravnini, druga dva pa sta pravokotno (najbolj oddaljena zelena krogla v beli sferi).
Zaradi ureditve teh ionov okoli CA2+ Octaedro je "orožje" in tako dodeli oktaedralno molekularno geometrijo.
Glede na to, kako so razporejene zelene sfere, lahko molekula vode nadomesti eno od teh, ki se pojavi z kapico2· H2Ali po možnosti v kvadratni ravnini. To dejstvo spreminja kristalno strukturo in, ko voda nadomešča zelene sfere, se ionska razporeditev bolj spreminja.
Ko vsi ioni Cl- Nadomeščajo jih molekule vode, tvori Cacl hidrat2· 6H2Tudi. Na tej točki je oktaedrona "vodna", molekule2+ OH-H-OH2).
Kalcij zapored lahko sprejme še več molekul vode, ne da bi spremenil uveljavljen delež. To pomeni, da je Cacl2· 6H2Ali lahko sprejmejo druge zapletene strukture, tako da upoštevamo kristalne polimere kalcija in vode.
Vendar so te strukture manj stabilne od tistih, ki jih postavljajo elektrostatične interakcije (CA2+ in Cl-) iz anhidridne soli.
Uporaba/uporabe kalcijevega klorida
Glavne aplikacije kalcijevega klorida so:
- Izogibajte se zmrzovanju vode pozimi. Kalcijev klorid pri raztapljanju ustvari zelo toploto in nato poveča temperaturo, ledu se pojavi. Zaradi tega se uporablja za zmanjšanje tveganja za kroženje ljudi in vozil med hladno postajo.
- Pomagajte nadzorovati prah na neasfaltiranih cestah.
- Ko se vlijete, pospešite hitrost sušenja betona.
- CACHL tekočine2 Učinkovitost vrtanja za črpanje plina iz njihovih podzemnih nahajališč se poveča, pa tudi nafta.
- Bazeni se dodajo za zmanjšanje erozije, ki jo utrpi beton njegovih sten. Zapeljani kalcij izpolnjuje to funkcijo.
- Ker gre za higroskopsko sol, lahko kalcijev klorid uporabimo kot discitiko.
- Uporablja se kot konzervans v nekaterih živilih, pa tudi aditiv v več, kot so energetske pijače, ki jih uporabljajo športniki, siri, piva itd.
- V medicinski praksi ima tudi uporabnost pri zdravljenju depresije, ki jo povzroča preveliko odmerjanje magnezijevega sulfata, pa tudi pri zastrupitvi s svincem.
Sinteza kalcijevega klorida
Naravni viri te spojine so Salmueras, pridobljene iz morja ali jezer.
Vendar njegov glavni vir izvira iz procesa Solvay, v katerem je apnenec (Caco3) Trpite vrsto transformacij, dokler ne izhajajo v kalcijevem kloridu By -Product:
2nacl (aq) + caco3(s) na2Co3(s) + cacl2(AC)
Izdelek, ki ga zanima ta postopek, je pravzaprav natrijev karbonat, NA2Co3.
Lastnosti kalcijevega klorida
Fizične lastnosti in Delicuescence
Je bela, stranišče in higroskopska trdna. Ta težnja po absorpciji vlage okolja je posledica bazičnosti Ca ionov2+.
Basicy of kakšna vrsta: Lewis ali Bronsted? Lewis, ker je pozitivna vrsta sposobna sprejeti elektrone. Te elektrone podarijo na primer s kisikovimi atomi molekul vode.
Trdna snov absorbira vlago do stopnje raztapljanja v isti vodi, ki uporablja svoje kristale. Ta lastnost je znana kot DelicuesCencia.
Njegova gostota je 2,15 g/ml. Ker v svojo strukturo vključuje vodo, je kristal "razširjen", kar povečuje njegovo volumen in posledično zmanjšuje gostoto. Samo cacl2· H2O Prekinitev s tem trendom, ki kaže večjo gostoto (2,24 g/ml).
Molekulska masa anhidridne soli je približno 111 g/mol, za vsako molekulo vode v svoji strukturi.
Topnost
Cacl2 Je zelo topen v vodi in v nekaterih polarnih topilih, kot so etanol, ocetna kislina, metanol in drugi alkoholi.
Toplota
Ko se postopek raztopi v vodi, je eksotermičen in zato segreva raztopino in okolico.
Vam lahko streže: od kod plastika? Zgodovina in vrsteTo je zato, ker vodni kompleks bolje stabilizira ca ione2+ V raztopini, ki elektrostatične interakcije s CL ioni-. Ker je izdelek bolj stabilen, trdna sila sprošča energijo v obliki toplote.
Elektrolitična razgradnja
Cacl2 Molten je lahko podvržen elektrolizi, fizičnem procesu, ki je sestavljen iz ločevanja spojine v njegovih elementih od delovanja električnega toka. V primeru te soli so izdelki kovinski kalcij in plinasti klor:
Cacl2(l) → Ca (s) + Cl2(g)
Ioni ca2+ V katodi so zmanjšani, medtem ko Cl ioni- So oksidirani na anodi.
Reference
- Wikipedija. (2018). Kalcijev klorid. Pridobljeno iz.Wikipedija.org
- Shiver & Atkins. (2008). Anorganska kemija. V elementih skupine 2. (Četrta izdaja., str. 278). MC Graw Hill.
- Pubchem. (2018). Kalcijev klorid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Oxychem. Kalcijev klorid: Vodnik po fizikalnih lastnostih. Oxy okreval.com
- Carole Ann. Pogoste uporabe kalcijevega klorida. Hunker si je opomogel.com