Selenhidric kislina (H2SE), kaj je, struktura, lastnosti, uporablja
- 2764
- 373
- Lee Farrell
 Vodik Seleniuro: dve molekuli vodika in ena od selena
Vodik Seleniuro: dve molekuli vodika in ena od selena Kaj je selenhidric kislina?
On Selenhidric kislina O vodik Seleniuro je anorganska spojina, katere kemijska formula je H2On. Je kovalentne narave, v običajnih temperaturnih in tlačnih pogojih pa je brezbarven plin; Toda z močnim prepoznavnim vonjem po manjši prisotnosti. Kemično gre za vleko, zato ima selen valencia -2 (i2-).
Od vseh Seleniuros, h2Je najbolj strupen, ker je njegova molekula majhna, njen selen atom. Po drugi strani njegov vonj omogoča tistim, ki sodelujejo z njim, da ga zaznajo v dejanju v primeru zunaj laboratorijskega zvona.
Vodik Seleniuro lahko sintetizira z neposredno kombinacijo njegovih dveh elementov: molekularni vodik, H2, in kovinski selen. Dobimo ga lahko tudi z raztapljanjem spojin, bogatih s selenom, kot je Iron Seleniuro (II), fese, v klorovodikovo kislino.
Po drugi strani se Selenhidric kislina pripravi z raztapljanjem vodika Seleniuro v vodi; To pomeni, da je prvi raztopljen v vodi, drugo pa brezalkoholne pijače.
Njegova glavna uporaba je biti vir selena v organski in anorganski sintezi.
Vodikova seleniuro struktura
 Vodikova molekula Seleniuro. Wikimedia Commons.
Vodikova molekula Seleniuro. Wikimedia Commons. H molekula2Je kotne geometrije, čeprav je njegov kot 91 ° videti bolj kot L kot V. V tem modelu kroglic in palic so vodikovi atomi in selen beli in rumeni sferi.
Ta molekula je, kot je prikazano, tista, ki je v plinski fazi; to je za vodik Seleniuro. Ko se raztopi v vodi, sprosti proton in v raztopini imate par HSE- H3Tudi+; Ta ionski navor prihaja do selenhidrične kisline, označene kot h2SE (AC), da ga ločimo od vodika Seleniuro, h2SE (g).
Vam lahko služi: metilen modra: značilnosti, priprava, uporabe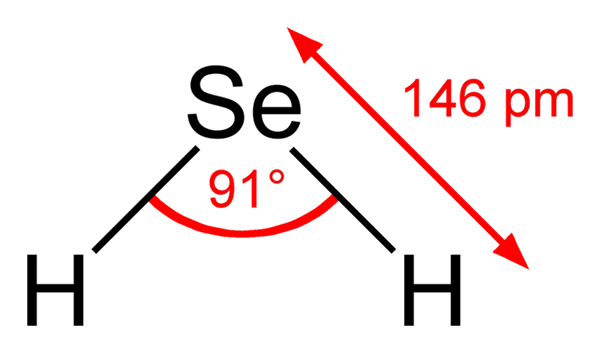 Strukturna formula seleenhidrične kisline. Ben Mills, Wikimedia Commons ..
Strukturna formula seleenhidrične kisline. Ben Mills, Wikimedia Commons .. Zato strukture med h2Se (ac) in h2Se (g) so zelo različni; Prvo je obdano z vodno sfero in ima ionske obremenitve, drugo pa je sestavljeno iz aglomerata molekul plinske faze.
H molekule2Komaj lahko komunicirajo med seboj skozi zelo šibke sile dipolo-dipolo. Selen, čeprav je manj elektronegativen kot žveplo koncentrira večjo elektronsko gostoto, da jo "ugrabi" iz atomov vodika.
Selenio hidri stisnjeni
Če h molekule2Doživljajo izjemen pritisk (na stotine GPA), teoretično pa so prisiljeni utrjevati tako, da tvorijo povezave Se-H-se; To so povezave treh centrov in dveh elektronov (3c-2e), kjer sodeluje vodik. Zato molekule začnejo tvoriti polimerne strukture, ki definirajo trdno snov.
V teh pogojih je mogoče obogatiti trdno snov z več vodika, kar popolnoma spremeni nastale strukture. Poleg tega sestava postane tip HnSE, kjer se N giblje od 3 do 6. Tako selenijevi hidridi, stisnjeni s temi pritiski, in v prisotnosti vodika imajo kemične formule h3Vem h6On.
Ocenjujejo, da imajo ti selenski hidrorji, obogateni z vodikom.
Lastnosti
Fizični videz
Brezbarven plin, ki pri nizkih temperaturah diši po putrefaktu in gnilih jajcih, če se koncentracija poveča. Njegov vonj je slabši in intenzivnejši od vodikovega sulfida (kar je že precej neprijetno). Vendar je to dobro, saj pomaga enostavno odkrivanje in zmanjšuje podaljšana tveganja za stike ali vdihavanje.
Ko gori, oddaja modrikast plamenski produkt elektronskih interakcij v atomih selena.
Vam lahko služi: žveplov oksidMolekularna masa
80,98 g/mol.
Vrelišče
-41 ° C.
Tališče
-66 ° C.
Parni tlak
9,5 atm pri 21 ° C.
Gostota
3.553 g/l.
Pkdo
3.89.
Topnost vode
0,70 g/100 ml. To potrjuje dejstvo, da selenski atom H2Ne morete oblikovati vodikovih mostov, ki so občutni z molekulami vode.
Topnost v drugih topilih
-Topno v cs2, kar ne preseneča kemična analogija med selenom in žveplom.
-Phosgen topen (pri nizkih temperaturah, saj vre pri 8 ° C).
Nomenklatura
Kot je razloženo v prejšnjih razdelkih, se ime te spojine razlikuje glede na to, ali h2Je v soda ali raztopljeni fazi v vodi. Ko je v vodi, se govori o seleenhidrični kislini, kar v anorganskem smislu ni nič drugega kot hidratiranje. Za razliko od molekul plina je njegov kisli značaj večji.
Vendar pa kot plin ali raztopljen v vodi, atom selena ohranja iste elektronske značilnosti; Na primer, njena Valencia je -2, razen če imate oksidacijsko reakcijo. Ta valencia od -2 je razlog, zakaj se imenuje SeleniAurohi vodika, saj je seleniuro anion2-; ki je bolj reaktiven in reduktor kot S2-, sulfid.
Če se uporablja sistematična nomenklatura, je treba določiti število vodikovih atomov v spojini. Tako, h2Imenuje se: Seleniuro of dalvodik.
Seleniuro ali hidrid?
Nekateri viri ga navajajo kot hidrid. Če bi bilo res, bi imel selen pozitiven naboj +2, vodikova negativna obremenitev -1: SEH2 (On2+, H-). Selen je bolj elektronegativni atom kot vodik, zato konča "monopolizacijo" najvišje elektronske gostote v H molekuli H2On.
Vam lahko služi: termokemijaVendar obstoja selenskega hidrida ni mogoče zavreči. Pravzaprav s prisotnostjo H anionov- Olajšal bi povezave Se-H, odgovorne za trdne strukture, oblikovane na velike pritiske v skladu z računalniškimi študijami.
Prijave
Metabolična
Čeprav se zdi nasprotujoče, kljub veliki strupenosti h2SE, nastaja v telesu na presnovni poti selena. Vendar se celice komaj proizvajajo kot posrednik v sintiju selenioproteinov ali se na koncu metilirajo in izločajo; Eden od simptomov tega je okus česna v ustih.
Industrijalisti
H2Uporablja se predvsem za dodajanje atomov selena v trdne strukture, kot so polprevodniški materiali; za organske molekule, kot so alkeni in nitrile za sintezo organskih seleniurosov; ali do raztopine za oborino kovinskih seleniurosov.
Reference
- Vodikov selenid. Pridobljeno iz: v.Wikipedija.org
- Vodik selenide, h2On. Okreval od: Selenium.Atomistjo.com

