Píchric kislina, kar je, struktura, sinteza, lastnosti
- 4078
- 734
- Mr. Shane Larkin
On Píchric kislina Gre. Njegova molekularna formula je c6H2(Ne2)3Oh. To je zelo kisli fenol in ga je mogoče najti kot natrijev pikrat, amonij ali kalij; to je v svoji ionski obliki c6H2(Ne2)3Ona.
Je trdna močna okus grenkega in od tam izhaja iz grške besede "Prikos", kar pomeni grenko. Najdemo ga kot mokri rumeni kristali. Njegova izsušitev ali dehidracija je nevarna, saj povečuje nestabilne lastnosti, zaradi katerih je eksploziven.
Píchric kislina se uporablja kot osnova za sintezo trajnih barvil rumenega tona. Nekateri patologi in raziskovalci ga uporabljajo pri fiksaciji ali obarvanju tkivnih odsekov in drugih imunohistokemijskih procesov.
Zelo je uporaben pri razvoju farmacevtskih izdelkov. Poleg tega se uporablja pri izdelavi tekem ali tekem in eksplozivov. Uporablja se tudi za snemanje kovin, za izdelavo barvnega stekla in v kolorimetrični določitvi bioloških parametrov, kot je kreatinin.
Struktura
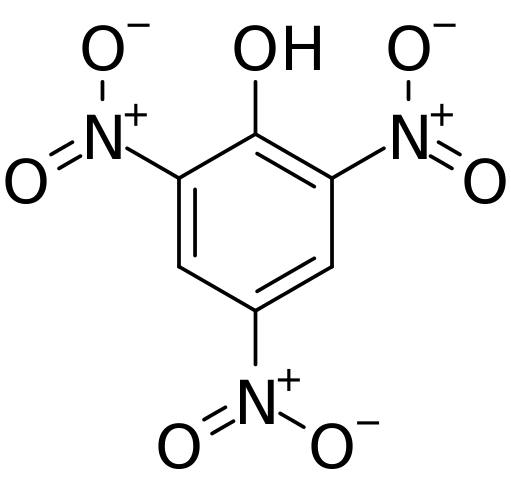
 Struktura in formalne obremenitve v pihorični kislini. Vir: CVF-PS [javna domena]
Struktura in formalne obremenitve v pihorični kislini. Vir: CVF-PS [javna domena] Na zgornji sliki so vse vezi in samo struktura molekule píchric kisline bolj prikazane. Sestavljen je iz fenola s tremi nitro substituenti.
Vidimo, da v skupinah ne2 Atom dušika ima pozitivno delno obremenitev in zato povpraševanje po elektronski gostoti iz okolice. Toda aromatični obroč privablja tudi elektrone proti sebi in pred tremi št2 konča del lastne elektronske gostote.
Zaradi tega je OH skupinski kisik bolj deli enega od svojih prostih elektronskih vrstnikov za zagotavljanje elektronskega pomanjkanja, ki ga utrpi obroč; In pri tem se tvori povezava c = o+-H. Ta pozitivna delna obremenitev kisika oslabi vez O-H, kislost pa se poveča; to pomeni, da bo sproščen kot vodikov ion, h+.
Kisli fenol
Zaradi tega je ta spojina izjemno močna kislina (in reagent), celo bolj kot sama ocetna kislina. Vendar je spojina res fenol, katerega kislost presega kot druge fenole; zaradi tega, kot je to že omenilo2.
Vam lahko služi: termodinamični procesiKer gre za fenol, ima skupina OH prednost in usmerja naštevanje v strukturi. Tri št2 Nahajajo se v ogljikih 2, 4 in 6 aromatičnega obroča glede na OH. Od tu izhaja nomenklaturo IUPAC za to spojino: 2,4,6-trinitrofenol (TNP).
Če skupine ne bi bilo2, Ali če bi bilo v obroču manjše število, bi O-H povezava manj oslabila, zato bi spojina imela manj kislosti.
Kristalna struktura
Molekule pikrinske kisline so urejene tako, da so naklonjene njihovim medmolekularnim interakcijam; bodisi za nastanek vodikovih mostov med skupinami OH in ne2, Sile dipolo-dipolo ali elektrostatične odbojnosti med revnimi regijami elektronov.
Lahko bi pričakovali, da skupine ne2 Med seboj odbijajo in vodijo v smeri sosednjih aromatičnih obročev. Prav tako prstani niso mogli poravnati drug na drugega zaradi povečanja elektrostatičnih odbojnosti.
Kot rezultat vseh teh interakcij, Píchric kislini uspe oblikovati tridimenzionalno mrežo, ki definira kristal; katere enotna celica ustreza kristalnemu sistemu ortorrombičnega tipa.
Sinteza
Sprva so ga sintetizirali iz naravnih spojin, kot so derivati živalskih rogov, naravne smole. Od leta 1841 je bil fenol uporabljen kot predhodnik picrične kisline po več poti ali skozi več kemijskih postopkov.
Kot že rečeno, je eden najbolj kislih fenolov. Za sintezo je najprej potrebno, da fenol trpi postopek sulfoniranja, čemur sledi postopek nitracije.
Sulfonanje brezvodni fenol se izvede pri zdravljenju fenola z dimno žveplovo kislino, ki se pojavlja aromatične elektrofilne substitucije H s skupinami sulfonata, torej3H, v položaju -orto in -para glede na skupino OH.
Ta izdelek, 2,4-Pynoldisulfonska kislina, se izvaja postopek nitracije, ki ga zdravi s koncentrirano dušikovo kislino. Pri tem sta dve skupini3H nadomeščajo nitro skupine, ne2, In tretjina vstopi v drugi položaj nitro. Naslednja kemična enačba to ponazarja:
Vam lahko služi: elastični materiali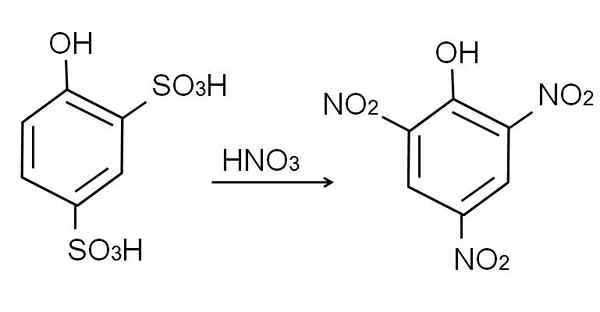 Kislinska nitracija 2,4-fenoldisulfonična. Vir: Gabriel Bolívar.
Kislinska nitracija 2,4-fenoldisulfonična. Vir: Gabriel Bolívar. Neposredna nitracija fenola
Prostora nitracije fenola ni mogoče izvesti neposredno, saj se cilji z visoko molekulsko maso ustvarijo. Ta metoda sinteze potrebuje zelo previden nadzor temperature, saj je zelo eksotermična:
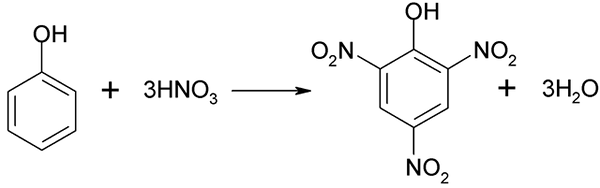 Neposredna nitracija fenola. Vir: akane700 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Neposredna nitracija fenola. Vir: akane700 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Píchric kislina lahko dobimo pri izvajanju neposrednega nitracijskega procesa 2,4-dinitrofenola z dušikovo kislino.
Druga oblika sinteze je zdravljenje benzena z dušikovo kislino in živalim nitratom.
Fizikalne in kemijske lastnosti
Molekularna teža
229.104 g/mol.
Fizični videz
Rumena masa mokrih kristalov.
Vonj
To je stranišče.
Okus
Je zelo grenka.
Tališče
122.5 ° C.
Vrelišče
300 ° C. Toda, pri topinju, eksplodira.
Gostota
1,77 g/ml.
Topnost
Je zmerno vodotopno spojino. To je zato, ker so vaše OH skupine in ne2 Z molekulami vode lahko komunicirajo z vodikovimi mostovi; Čeprav je aromatični obroč hidrofobni in zato škodi svoji topnosti.
Jedkost
Pikrinska kislina je na splošno jedka za kovine, razen za kositer in aluminij.
PKA
0,38. Je močna organska kislina.
Nestabilnost
Za Píchric kisline je značilno, da ima nestabilne lastnosti. Predstavlja tveganje za okolje, je nestabilen, eksploziven in strupen.
Shranjen je dobro zaprt, da se prepreči dehidracija, saj je picrična kislina zelo eksplozivna, če se pusti, da se posuši. Morate biti zelo previdni pri njegovi brezvodni obliki, saj je zelo občutljiv na trenje, udarce in toploto.
Pihhlalno kislino je treba shranjevati na prezračenih, svežih mestih, daleč od oksidacijskih materialov. Igralno je, da stikate s kožo in sluznico, ne smete ga zaužiti in je strupeno za telo.
Prijave
Píchric kislina se pogosto uporablja na raziskovalnem področju, v kemiji, v industriji in na vojaškem področju.
Preiskava
Kadar se uporablja kot celična in tkiva, izboljša rezultate barv s kislimi barvili. Zgodi se z metodami trihromskih barv. Po nastavitvi tkanine s formalinom se priporoča nova fiksacija s píchric kislino.
Vam lahko služi: Pritisnite filter: značilnosti, deli, kako deluje, uporabljaNa ta način je zagotovljeno intenzivno in zelo svetlo obarvanost tkiv. Dobri rezultati dobimo z osnovnimi barvili. Vendar morajo previdnostni ukrepi.
Organska kemija
-V organski kemiji se uporablja kot alkalne picrate za identifikacijo in analizo različnih snovi.
-Se uporablja v kovinski analitični kemiji.
-V kliničnih laboratorijih se uporablja pri določanju serumske in urinske ravni kreatinina.
-Uporablja se tudi v nekaterih reagentih, ki se uporabljajo za analizo ravni glukoze.
V industriji
-Na ravni fotografske industrije je bila píchric kislina uporabljena kot senzibilizator v fotografskih emulzijah. Je bil med drugim del izdelave izdelkov, kot so pesticidi, močni insekticidi.
-Píchric kislina se uporablja za sintezo drugih vmesnih kemičnih spojin, kot sta kloropikrin in picramična kislina, na primer. Iz teh spojin so bila razvita nekatera zdravila in barvila za usnjeno industrijo.
-Pri zdravljenju opeklin, kot so antiseptik in drugi pogoji.
-Pomembna komponenta s svojo eksplozivno naravo pri izdelavi tekem in baterij.
Vojaške prijave
-Zaradi visoke eksplozivnosti píchric kisline se uporablja v rastlinah vojaškega orožja.
-Uporabljena je bila stisnjena s píchric kislina.
-Amonijeva sol pikrilne kisline je bila uporabljena kot eksploziva, je zelo močna, vendar manj stabilnost kot TNT. Nekaj časa je bil uporabljen kot komponenta raketnega goriva.
Strupenost
Dokazano je, da je zelo strupen za človeški organizem in na splošno za vsa živa bitja.
Priporočljivo je, da se izognete njenemu vdihavanju in zaužitju, da imate akutno oralno strupenost. Povzroča tudi mutacijo v mikroorganizmih. Predstavlja strupene učinke na prostoživeče živali, pri sesalcih in na splošno v okolju.
Reference
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Univerza Purdue. (2004). Eksplozija picrične kisline. Pridobljeno od: chemed.Kem.Purdue.Edu
- « Patricia Benner Biografija, teorija in drugi prispevki
- Maguey kaj je, značilnosti, habitat, razmnoževanje »

