Smorostinska kislina (HCOOH)
- 3001
- 266
- Lee Farrell
Pojasnjujemo, kaj je mravljična kislina, njegove lastnosti, strukture in aplikacije
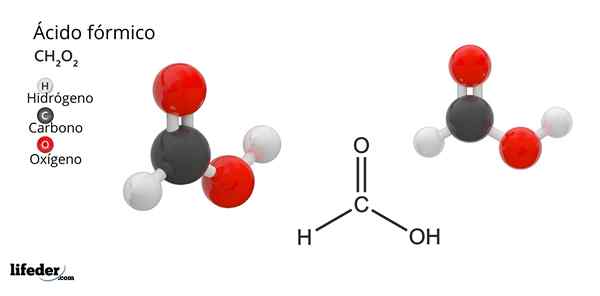
 Formula in struktura mravljične kisline
Formula in struktura mravljične kisline Kaj je mravljična kislina?
On mravljinčna kislina ali metan kislinaJe najpreprostejša in majhna spojina vseh organskih kislin. Znana je tudi kot metanska kislina, njegova molekularna formula pa je HCOOH, ki ima samo vodikov atom, povezan z ogljikovim atomom. Njegovo ime izhaja iz besede formica, kar v latinščini pomeni mrav.
Naravoslovci iz petnajstega stoletja so ugotovili, da nekatere vrste žuželk (formeícidos), kot so mravlje, termiti, čebele in hrošči, izločajo to spojino, odgovorno za njihovo bolečo sesekljano. Tudi te žuželke uporabljajo mravljično kislino kot mehanizem za napad, obrambo in kemično znamenje.
Imajo strupene žleze, ki izločajo to in druge kisline (na primer ocetna kislina), kot je rosa zunaj. Muhnalna kislina je močnejša od ocetne kisline (ch3Cooh); Zato raztopljena v enakih količinah v vodi, mravljinska kislina proizvaja raztopine z nižjimi vrednostmi pH.
Angleški naravoslovec John Ray je leta 1671 dosegel izolacijo mravljinske kisline in jo odlikoval iz velikih količin mravelj.
Po drugi strani je prvo uspešno sintezo te spojine opravil francoski kemik in fizik Joseph Gay-Lussac z uporabo nočne kisline (HCN) kot reagenta.
Kje je mravljična kislina?
 Mravlje izločajo mravljično kislino
Mravlje izločajo mravljično kislino Formična kislina je lahko prisotna na zemeljski ravni, kot sestavina biomase ali v atmosferi, ki sodeluje v širokem spektru kemijskih reakcij; Najdemo ga celo pod tlemi, znotraj olja ali v plinski fazi na njegovi površini.
Glede na biomaso so žuželke in rastline glavni generatorji te kisline. Ko se fosilna goriva zgorejo, proizvajajo plinasto mravčno kislino; Posledično motorji vozila sproščajo mravljično kislino v atmosfero.
Vendar pa Zemlja gosti pretirano število mrave. Tudi gozdni požari predstavljajo plinaste vire mravljične kisline.
Lahko vam služi: litij: zgodovina, struktura, lastnosti, tveganja in uporabeZgoraj se v kompleksni atmosferski matriki pojavljajo fotokemični procesi, ki sintetizirajo mravljično kislino.
Na tej točki se veliko hlapnih organskih spojin (VOC) razgradi pod učinki ultravijoličnega sevanja ali jih oksidirajo z mehanizmi prostih radikalov OH. Bogata in zapletena atmosferska kemija je daleč prevladujoči vir formalne mravljične kisline.
Struktura mravljinčenja
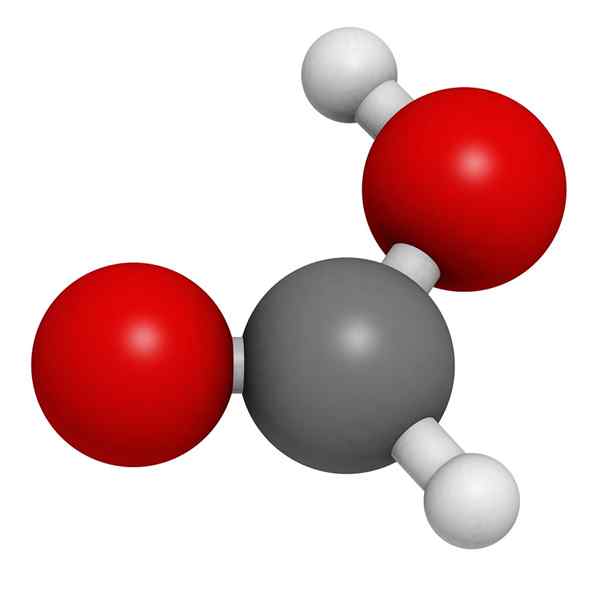 Molekularni model mravljične kisline
Molekularni model mravljične kisline Na vrhunski sliki je prikazana struktura plinske faze mravljične kisline. Bele krogle ustrezajo atomom vodika, rdečim kisikom in črnim atomom do ogljikovih atomov.
V teh molekulah lahko cenimo dve skupini: hidroksil (-oh) in formil (-ch = o), ki sta sposobna oblikovati vodikove mostove.
Te interakcije so tipa O-H-O, saj so hidroksili skupine darovalcev H in skupin, ki oblikujejo darovalce ali.
Vendar H, povezan z ogljikovim atomom, nima te zmogljivosti. Te interakcije so zelo močne in je zaradi atoma H slabega v elektronih vodik skupine OH bolj kisel; Zato ta vodik še naprej stabilizira mostove.
Zaradi zgoraj navedenega mračnika obstaja v obliki vijakov in ne kot posamezna molekula.
Kristalna struktura
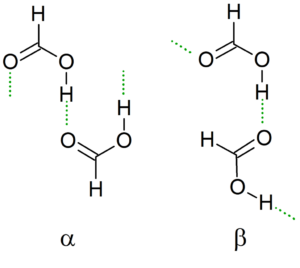
Ko se temperatura spušča, dimer vodi svoje vodikove mostove, da ustvari najbolj stabilno možno strukturo skupaj z drugimi dimerji, s čimer ustvari neskončne verige α in β mravljične kisline.
Druga nomenklatura sta "CIS" in "trans" konformerji. V tem primeru se "CIS" uporablja za označevanje skupin, usmerjenih v isto smer, in "trans" za te skupine v nasprotnih naslovih.
Vam lahko služi: Tanteo ravnovesje: koraki, primeri in vajeNa primer, v verigi α, formile skupine "kažejo" na isto stran (levo), v nasprotju z β verigo, kjer te formilne skupine kažejo na nasprotne strani (nadrejena slika).
Ta kristalna struktura je odvisna od fizičnih spremenljivk, ki delujejo na njej, kot sta tlak in temperatura. Tako so verige kabriolet; to pomeni, da se lahko v različnih pogojih veriga "cis" spremeni v "trans" verigo in obratno.
Če se pritiski povečajo na drastične ravni, so verige dovolj stisnjene, da se štejejo za kristalni polimer mravljične kisline.
Lastnosti mravljinčenja
Spodaj so omenjene fizikalne in kemijske lastnosti mravljične kisline:
- Muzenska kislina je tekočina pri sobni temperaturi, brezbarvna in z močnim in prodornim vonjem. Ima molekulsko maso 46 g/mol, topi se na 8,4 ° C in ima vrelišče 100,8 ° C, večjo kot pri vodi.
- Menjava je v vodnih in polarnih organskih topilih, kot so eter, aceton, metanol in etanol.
- Po drugi strani pa je v aromatičnih topilih (kot sta benzen in toluen) rahlo topna, ker ima mravljinska kislina komaj atom ogljika v svoji strukturi.
- Ima PKA 3,77, bolj kislino kot pri ocetni kislini, kar je mogoče razložiti, ker metilna skupina zagotavlja elektronsko gostoto oksidiranega ogljikovega atoma z obema kisikoma. Posledica tega je rahlo spuščanje kislosti protona (CH3COOH, HCOOH).
- Ne glede na kislino, to postane anion hcoo format-, ki lahko democicirajo negativno obremenitev med dvema atoma kisika. Zato je stabilen anion in pojasnjuje veliko kislost mravljične kisline.
Reakcije
Smorozensko kislino lahko dehidriramo v ogljikovem monoksidu (CO) in v vodi. V prisotnosti platinskih katalizatorjev se lahko razgradi tudi v molekularni vodik in ogljikov dioksid:
Hcooh (l) → h2(g) + co2(g)
Ta lastnost omogoča, da se mravljična kislina šteje za varen način za shranjevanje vodika.
Uporaba/uporabe mravljinčeve kisline
Industrija hrane in kmetijstva
Kljub temu, kako škodljiva mravljična kislina se lahko uporablja pri ustreznih koncentracijah kot konzervans v hrani zaradi svojega antibakterijskega delovanja. Iz istega razloga se uporablja v kmetijstvu, kjer ima tudi pesticide.
Predstavlja tudi konzervirno delovanje na pašnikih, kar pomaga preprečiti črevesne pline pri plemenskih živalih.
Industrija tekstila in obutve
Uporablja se v tekstilni industriji pri obarvanju in izpopolnjevanju tekstila, morda najpogostejša uporaba tega kisline.
Formonska kislina se uporablja pri obdelavi usnja zaradi svojega bednega delovanja in pri izločanju las tega materiala.
Varnost v cestnem prometu na cestah
Poleg navedene industrijske uporabe se tisti, ki izhajajo iz formalne kisline (formatov), v Švici in Avstriji pozimi uporabljajo tudi na cestah, da bi zmanjšali tveganje za nesreče. To zdravljenje je učinkovitejše od uporabe skupne soli.
Reference
- Tellus (1988). Atmosferska oblika iz mravlje Formicine: predhodna ocena408, 335-339.
- B. Millet et al. (2015). Viri in ponori atmosferske mravljične kisline. Atmos. Kem. Phys., 15, 6283-6304.
- Wikipedija. (2018). MRAVLJINČNA KISLINA. Pridobljeno iz.Wikipedija.org
- Aktivno. MRAVLJINČNA KISLINA. Okrevano od Actipedije.org
- Doktor. N. K. Patel. Modure: 2, predavanje: 7. MRAVLJINČNA KISLINA. Nptel si je opomogel.AC.v
- Jean in Fred. (14. junij 2017). Zapuščanje Mounds termitov. [Slika]. Okreval od: flickr.com

