Kemična struktura borove kisline, lastnosti, priprave, uporabe

- 993
- 174
- Raymond Moen
On Borova kislina To je anorganska spojina, katere kemijska formula je h3BO3. Sestavljen je iz bele ali brezbarvne trdne snovi. Šibka kislina je v vodni raztopini, odvisno od koncentracije, pH med 3,8 in 4,8. V hladni in zmerno topni vročo vodo je malo topno.
Borovo kislino je leta 1702 odkril Wilhelm Man.
 Trden vzorec borove kisline na uri stekla. Vir: Walkerma prek Wikipedije.
Trden vzorec borove kisline na uri stekla. Vir: Walkerma prek Wikipedije. Vendar je tudi poudarjeno, da je Boerg borovo kislino pripravil tako.
Ta kislina je zelo uporabna spojina, ki ima številne aplikacije v industriji in medicini, ki se uporablja tudi kot insekticid, ohranjanje lesa, zaostali ogenj in je sestavina rešitve za pH.
[TOC]
Kemična struktura
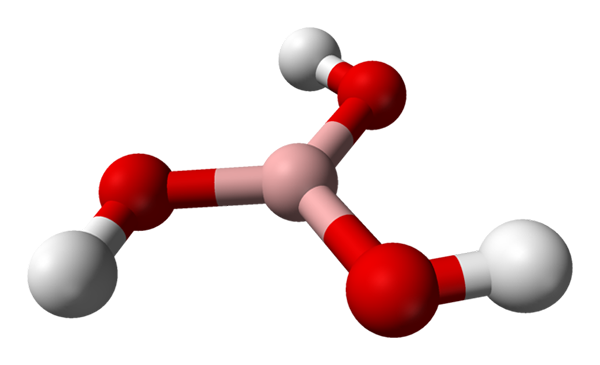 Molekula borove kisline, ki jo predstavlja model kroglic in palic. Vir: Benjah-BMM27 [javna domena]
Molekula borove kisline, ki jo predstavlja model kroglic in palic. Vir: Benjah-BMM27 [javna domena] Na vrhunski sliki imamo samo molekulo H3BO3. Upoštevajte, da vodikovi atomi, ki jih predstavljajo bele krogle, niso povezani z atomom osrednjega bora, kot bi lahko nakazovali kemijsko formulo; ampak atome kisika, ki jih predstavljajo rdeče krogle.
Tako je bolj priročna formula, čeprav manj uporabljena, za borovo kislino B (OH)3, kar kaže na to, da je njihova kislost posledica H ionov+ Osvobojen od svojih skupin OH. Molekula B (OH)3 Ima trigonalno ravno geometrijo, z atomom bora pa ima kemično hibridizacijo sp2.
B (OH)3 Je kovalentna visoka molekula, saj razlika v elektronegativnosti med atomom bora in kisikom ni zelo velika; Torej so povezave B-O v bistvu kovalentne. Upoštevajte, da struktura te molekule spominja na strukturo predilnika. Ali lahko na enak način vklopim vašo osi?
Kristali
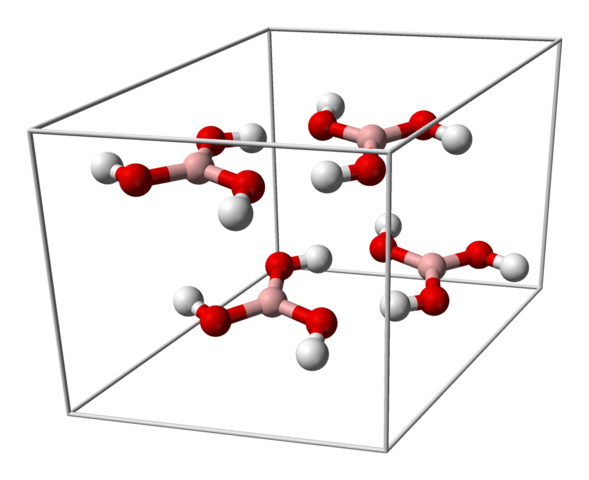 Enotna celica za kristal H3BO3. Vir: Benjah-BMM27 [javna domena]
Enotna celica za kristal H3BO3. Vir: Benjah-BMM27 [javna domena] Zgornja slika prikazuje enotno celico, ki ustreza triciklirani kristalni strukturi za borovo kislino, ki lahko v določenih sintezi sprejme kompaktno šesterokotno strukturo. Upoštevajte, da obstajajo štiri molekule na enotno celico, ki so naročene v dveh slojih, A in B, ki se izmenita (niso nameščeni drug na drugem).
Zaradi simetrije in vodenja povezav B-OH je mogoče domnevati, da je B (OH)3 Je apolarna; Vendar obstoj intermolekulskih vodikovih mostov spreminja zgodovino. Vsaka molekula B (OH)3 Dati ali sprejeti tri od teh mostov s skupno šestimi interakcijami dipola-dipolo, kot so tiste, ki so jih opazili na spodnji sliki:
Vam lahko služi: terpenos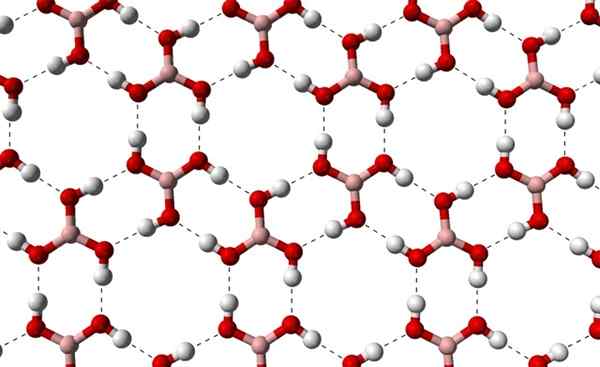 Kristalne plasti H3BO3, opažene iz višje osi. Vir: Benjah-BMM27 [javna domena]
Kristalne plasti H3BO3, opažene iz višje osi. Vir: Benjah-BMM27 [javna domena] Upoštevajte, da so ti vodikovi mostovi usmerjene interakcije, ki urejajo kristale borove kisline, in vzpostavljajo vzorce okrasnih vidikov; Notranji obroči morda z zadostnim prostorom, da preprečijo nekatere nečistoče, ki niso v kristalnih napakah.
Ti vodikovi mostovi kljub nizki molekulski masi B (OH)3, Svoje steklo ohranjajo dovolj, da potrebuje temperaturo 171 ° C, da se tapi. Ni znano, kakšni učinki bi imeli visoke pritiske (v vrstnem redu GPA) na molekularnih plasti B (OH)3.
Lastnosti
Imena
Iupac: borova kislina in trihidrooksidobor. Druga imena: ortoborična kislina, borena kislina, sassolit, borofax in trihidroksiborano.
Molarna masa
61.83 g/mol
Fizični videz
Kristalna, brezbarvna in prozorna bela trdna. Doseženo je tudi kot zrnca ali v obliki belega prahu. Rahlo neokusno na dotik.
Vonj
Stranišče
Okus
Rahlo grenko
Tališče
170,9 ° C
Vrelišče
300 ° C
Topnost vode
Zmerno topno v hladni in topni vodi v vroči vodi:
2,52 g/100 ml (0 ° C)
27,50 g/100 ml (100 ° C)
Borna kislina je delno topna v vodi in se vanj potopi. Ta topnost se ponavadi poveča v prisotnosti kislin, kot so klorovodiko.
Topnost v drugih topilih
-Glicerol: 17,5 % pri 25 ° C
-Etilen glikol: 18,5 % pri 25 ° C
-Aceton: 0,6 % pri 25 ° C
-Etil acetat: 1,5 % pri 25 ° C
-Metanol: 172 g/l a 25 ° C
-Etanol: 94,4 g/L A 25 ° C
Koeficient oktanola/vode
Dnevnik p = -0,29
Kislost (PKA)
9.24. 12.4. 13.3. To so tri konstante njihovih disociacij, da sprostijo h+ V vodi.
ph
3,8 - 4,8 (3,3 % v vodni raztopini)
5.1 (0,1 molarja)
Parni tlak
1,6 · 10-6 mmhg
Stabilnost
Stabilno v vodi
Razgradnja
Se pokvari, ko se segreje nad 100 ° C, ki tvori borični anhidrid in vodo.
Reaktivnost
Borna kislina tvori topne soli z monovalentnimi kationi, na primer: NA2B4Tudi7.10H2Ali, in netopne soli z dvovalentnimi kationi, kabina4Tudi7.6H2Tudi.
V vodni raztopini proizvaja kislo raztopino, misleč, da je ta lastnost posledica odštevanja skupin OH- vode. Borinska kislina je usposobljena kot šibka kislina tipa Lewis.
Borinska kislina reagira z glicerolom in manitolom, kar poveča kislost vodnega okolja. PKA je spremenjena od 9,2 do 5, zaradi nastanka boro-manitol quelato [BC6H8Tudi2(OH)2]-, ki sprošča h+.
Priprava
Borinska kislina je v prostem stanju v vulkanskih emanacijah v regijah, kot so Toskana Italije, Lipari otoki in v zvezni državi Nevada, ZDA. Najdemo ga tudi v mineralih, kot so Borax, Boracita, Ulexita in Colemanita.
Vam lahko služi: halogeniBorova kislina se pripravlja predvsem z reakcijo minerala boraksa (natrijev natrijev tetrabora) z mineralnimi kislinami, kot so klorovodikova kislina, žveplova kislina itd.
Na2B4Tudi9· 10H2O +hcl => 4 h3BO3 + 2 NaCl +5 h2Tudi
Pripravljen je tudi s hidrolizo Boro in Diborano Trihaluro.
Borova kislina je pripravljena iz collemanita (CA2B6Tudienajst· 6 h2Da). Postopek je sestavljen iz zdravljenja minerala z žveplovo kislino za raztapljanje boronskih spojin.
Nato je ločena raztopina, kjer je prisotna borova kislina nehote fragmentov. Raztopina vodikovega sulfida se zdravi, da obori nečistoče arzena in železa. Supernatant se ohladi, da nastane oborino borove kisline in ga loči od suspenzije.
Prijave
V industriji
Borova kislina se uporablja v izdelavi vlaken. S prispevanjem k zmanjšanju tališča poveča moč in učinkovitost tekstilnih steklenih vlaken: material, ki se uporablja za okrepitev plastike, ki se uporablja v plovilih, industrijskih cevi in ploščah računalniških vezij.
Borinska kislina sodeluje pri izdelavi borosiliziranega stekla, ki omogoča pridobivanje stekla odporno stekla, uporabnega v gospodinjski kuhinji, v steklenem materialu laboratorijev, fluorescentnih cevi, optičnih vlaken, LCD zaslonih itd.
Uporablja se v metalurški industriji za otrditev in obdelavo jeklenih zlitin ter daje prednost kovinskim oblogom materialov.
Uporablja se kot kemična komponenta pri hidravličnem lomljenju (fracking): metoda, ki se uporablja pri ekstrakciji nafte in plina. Borinska kislina deluje kot zavor požara v celuloznih materialih, plastiki in tekstilu, ki so impregnirani z borovo kislino, da povečajo njihovo požarno odpornost.
V medicini
Borova kislina se uporablja razredčena pri pranju oči. Želatinske kapsule borove kisline se uporabljajo za zdravljenje glivičnih okužb, zlasti Candida albicans. Uporablja se tudi pri zdravljenju aken.
Borova kislina je posuta v nogavicah, da prepreči okužbe z nogami, kot je športnikova stopala. Prav tako se pri zdravljenju zunanjega otisa pri ljudeh in pri živalih uporabljajo raztopine, ki vsebujejo borovo kislino.
Borova kislina se doda v steklenici, ki se uporabljajo za zbiranje urina, kar preprečuje bakterijsko kontaminacijo, preden jo pregledajo v diagnostičnih laboratorijih.
Lahko vam služi: indolaletna kislina: struktura, lastnosti, pridobivanje, uporabeInsekticid
Borova kislina se uporablja pri nadzoru proliferacije žuželk, kot so ščurki, termiti, mravlje itd. Ščurki ne ubijajo takoj, saj najprej vpliva na prebavne in živčne sisteme, poleg tega, da uniči njegov eksoskelet.
Borinska kislina počasi izvaja, kar omogoča žuželke, ki so mu zaužile, da pride v stik z drugimi žuželkami in s tem širi zastrupitev.
Ohranitev
Borova kislina se uporablja za preprečevanje napada lesa z glivami in žuželkami, v ta namen pa v povezavi z etilen glikolom. To zdravljenje je učinkovito tudi pri nadzoru mulja in alg.
PH amortiber
Borna kislina in njegova konjugirana baza tvorita sistem za dušenje PKA = 9,24, kar kaže na to, da ima ta amortiber največjo učinkovitost za alkalni pH, ki niso običajni pri živih bitjih. Vendar se borato amortiber uporablja pri regulaciji pH v bazenih.
Jedrski reaktorji
Borinska kislina ima sposobnost zajemanja toplotnih nevtronov, kar zmanjšuje možnost ne -nadzorovane jedrske cepitve, ki lahko povzroči jedrske nesreče.
Kmetijstvo
Boro je bistven element za rast rastlin, ki je povzročil uporabo borove kisline za prispevek elementa. Vendar lahko v odvečni boronski kislini poškoduje rastline, zlasti citrusi.
Kontraindikacije
Uporaba borove kisline na izdelan izdelka, rane ali opekline, ki omogoča absorpcijo istega. To je strupena spojina znotraj telesa in v nekaterih primerih lahko povzroči omedlevino, napade, krče, obrazne tike in arterijsko hipotenzijo.
Z zdravnikom se je treba posvetovati z uporabo vaginalnih kapsul borove kisline pri nosečnicah, saj je bilo poudarjeno, da lahko deformacije ploda in zmanjšanje otrokove telesne teže ob rojstvu nastanejo ob rojstvu.
Namestitev borove kisline, ki se uporablja kot insekticid, na mestih, ki so na voljo otrokom, saj imajo otroci večjo dovzetnost za strupeno delovanje borove kisline, pri čemer v njih vzpostavi smrtni odmerek v 2.000 do 3.000 mg.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). BOROVA KISLINA. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). BOROVA KISLINA. Baza podatkov Pubchem. Cid = 7628. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Uredniki Enyclopeedia Britannica. (28. marec 2019). BOROVA KISLINA. Encyclopædia Britannica. Okrevano od: Britannica.com
- Nosilca vibrira. (9. november 2018). Skrite uporabe budne kisline v vašem vsakdanjem življenju. Okrevano od: Carriervibrating.com
- Nacionalni informacijski center za pesticide. (s.F.). BOROVA KISLINA. Okrevano od: NPIC.Orst.Edu
- Priprava. (30. november 2017). Borna kislina: lastnosti in uporabe te kemične spojine. Pridobljeno iz: kisline.Informacije
- Klorurosodij. (2019). Borova kislina. Okrevano od: klorurosodij.com
- Špansko društvo bolnišnične lekarne. (s.F.). Borova kislina. [PDF]. Pridobljeno iz: skupine dela.Sefh.je

