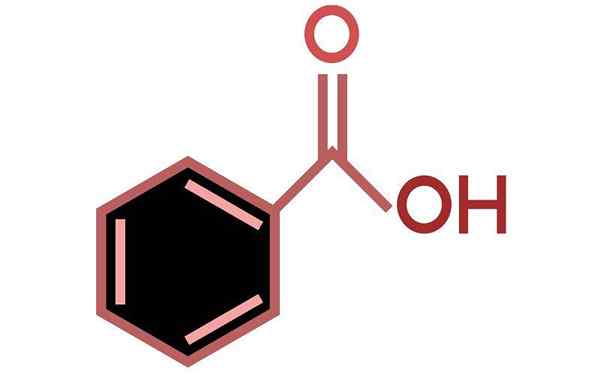
Benzojska kislina (C6H5COOH)
- 4832
- 1435
- Adrian Legros
 Benzojska kislina je aromatična karboksilna kislina
Benzojska kislina je aromatična karboksilna kislina Kaj je benzojska kislina?
On Benzojska kislina Je najpreprostejša aromatična kislina od vseh, ki ima kot molekularno formulo C6H5COOH. V naravi ga najdemo v številnih rastlinah, zlasti v sadju, kot sta marelice in borovnice. Pojavi se tudi pri bakterijah kot stranski produkt presnove aminokisline fenilalanina.
V črevesju ga ustvarja bakterijska (oksidativna) predelava polifenolov, prisotnih v nekaterih živilih.
C6H5COOH je, za razliko od mnogih kislin, trdna spojina, sestavljena iz lahkih, belih in filiformnih kristalov, ki oddajajo mandlje in značilno aromo.
Ena glavnih zmogljivosti benzojske kisline je zaviranje rasti kvasa, plesni in nekaterih bakterij, zato se uporablja kot konzervans za hrano.
Čeprav ni posebej strupena spojina, ima nekaj škodljivih dejanj za zdravje. Kdo priporoča največji odmerek 5 mg/kg telesne teže/dan, kar ustreza dnevnemu vnosu 300 mg benzojske kisline.
Struktura benzojske kisline
 Struktura benzojske kisline. Vir: Wikimedia Commons
Struktura benzojske kisline. Vir: Wikimedia Commons Vrhunska slika predstavlja strukturo benzojske kisline v modelu bara in kroglic.
Če se šteje število črnih kroglic, bo preverjeno, da jih je šest, to je šest ogljikovih atomov, dve rdeči sferi, ki ustrezata dvema kisikovih atomih karboksilne skupine, -Cooh in na koncu bele krogle so atomi vodika.
Na levi strani imate aromatični obroč, katerega aromatičnost je prikazana z diskontinuiranimi črtami na sredini obroča. In na desni, skupina -cooh, odgovorna za kislinske lastnosti te spojine.
Molekularno, c6H5COOH ima ravno strukturo, ker imajo vsi njeni atomi (razen vodikov) hibridizacijo SP2.
Po drugi strani pa skupina -cooh, zelo polarna, omogoča trajni dipol v strukturi.
To dejstvo ima za posledico C6H5COOH lahko komunicira s seboj prek sil Dipole-Dipolo. Konkretno s posebnimi vodikovimi mostovi.
Če opazimo skupino -Cooh, bomo ugotovili, da lahko kisik C = O sprejme vodikov most, medtem ko jih O -H kisik podari.
Kristalni in vodikovi mostovi
Benzojska kislina lahko tvori dva vodikova mostova: sprejema in sprejema enega hkrati. Zato tvori dímeros, to je, da je njegova molekula "povezana" z drugo.
To so pari ali dimerji, c6H5COOH-HOOCC6H5, strukturna podlaga, ki določa trdno snov, ki je posledica njegovega načrtovanja v vesolju.
Vam lahko služi: diatomični elementiFizikalne in kemijske lastnosti benzojske kisline
Kemična imena
Kislina:
-benzoični
-benzenokarboksilni
-Dracil
-Karboksibenzen
-benzenoforemični
Molekularna formula
C7H6Tudi2 ali c6H5COOH
Molekularna teža
122,123 g/mol.
Fizični opis
Trdna ali v obliki kristalov, običajno bela, vendar lahko predstavlja bež barvo, če je določene nečistoče. Njegovi kristali so shema ali v obliki igle.
Vonj
Diši po mandljih in je lepo.
Okus
Brez okusa ali rahlo grenka. Omejitev zaznavanja okusa je 85 ppm.
Vrelišče
480 ° F A 760 mmHg (249 ° C).
Tališče
252,3 ° F (121,5-123,5 ° C).
točka vžiga
250 ° F (121 ° C).
Sublimacija
Lahko sublimizira iz 100 ° C.
Topnost vode
3,4 g/l a 25 ° C.
Topnost v organskih topilih
- 1 g benzojske kisline se raztopi v prostornini, ki je enaka: 2,3 ml hladnega alkohola, 4,5 ml kloroforma, 3 ml etra, 3 ml acetona, 30 ml ogljikovega tetraklorida, 10 ml benzena, 30 ml ogljikovega disulfida, in 2,3 ml treem olja.
- Je tudi topna v nestanovitnih in fiksnih oljih.
- V oljnem etru je rahlo topen.
- Njegova topnost v heksanu je 0,9 g/L, v metanolu 71,5 g/l in v toluenu 10,6 g/l.
Gostota
1,316 g/ml pri 82,4 ° F in 1.2659 g/ml pri 15 ° C.
Gostota pare
4,21 (z zračnim razmerjem kot referenco = 1)
Parni tlak
1 mmHg pri 205 ° F in 7,0 x 10-4 mmhg pri 25 ° C.
Stabilnost
Raztopina s koncentracijo 0,1% v vodi je stabilna vsaj 8 tednov.
Razgradnja
Razpade s segrevanjem, oddajanjem hektarja in dražilnega dima.
Goo
1,26 cpoise pri 130 ° C.
Toplota zgorevanja
3227 kJ / mol.
Toplota za uparjanje
534 kJ /mol pri 249 ° C.
ph
Približno 4 v vodi.
Površinska napetost
31 n/m a 130 ° C.
PKA
4.19 do 25 ° C.
Lomni količnik
1,504-1,5397 (ηd) pri 20 ° C.
Reakcije
- V stiku z bazami (NaOH, Koh itd.) Tvori prodajo benzoat. Na primer, če reagirate z obliko NaOH, natrijevega benzoata, c6H5Pot.
- Reagira z alkoholi, da tvori estre. Na primer, njegova reakcija na etilni alkohol izvira iz etilnega estra. Nekateri estri benzojske kisline izpolnjujejo funkcijo kot mehčalci.
- Reagira s fosforjem pentakloridom, PCL5, Da tvori Benzoil -ov klorid, kislinski halorid. Benzoil klorid lahko reagira z amonijem (NH3) ali amin kot metilamin (CHO3Nh2) Oblikovati benzamid.
- Reakcija benzojske kisline z žveplovo kislino proizvaja sulfoniranje aromatičnega obroča. Funkcionalna skupina -so3H nadomesti atom vodika v ciljnem položaju obroča.
Lahko vam služi: prva revolucija kemije- Reagira lahko z dušikovo kislino, z uporabo žveplove kisline kot katalizatorja, ki tvori meta-nitrobenzojsko kislino.
- V prisotnosti katalizatorja, kot je železov klorid, FECL3, Benzojska kislina reagira s halogeni. Na primer, reagira s klorom za nastanek meta-klorobenzojske kisline.
Proizvodnja
Nekatere proizvodne metode te spojine:
- Večina benzojske kisline se industrijsko pojavlja z oksidacijo toluena s kisikom, ki je prisoten v zraku. Postopek katalizira kobaltni bencin, pri temperaturi 140-160 ° C in pri tlaku 0,2-0,3 MPa.
- Toluen lahko klorira za proizvodnjo benzotriklirida, ki ga pozneje hidrolizira z benzojsko kislino.
- Hidroliza benzonitrila in benzamida v kislem ali alkalnem mediju lahko povzroči benzojsko kislino in njegove konjugirane baze.
- Benzil alkohol v oksidaciji, ki ga v vodnem mediju posreduje kalijev permanganat, proizvaja benzojsko kislino. Reakcija se zgodi s segrevanjem ali refluksom. Ko je postopek zaključen, se zmes filtrira, da odstranimo manganov dioksid, supernatant.
- Spojina benzoktiklorida reagira s kalcijevim hidroksidom, pri čemer uporablja železove ali železne soli kot katalizatorji, sprva tvori kalcijev benzoat, CA (C (C (C6H5COO)2. Nato se ta sol z reakcijo s klorovodikovo kislino pretvori v benzojsko kislino.
Uporaba benzojske kisline
Industrijalisti
- Uporablja se pri proizvodnji fenola z oksidativno dekarboksilacijo benzojske kisline pri temperaturah 300-400 ° C, ker lahko fenol uporabimo pri sintezi najlona.
- Iz njega benzoat glikol, kemični predhodnik ester dietilen glikola in trietilen glikol ester, snovi, ki se uporabljajo kot mehčalci. Morda so najpomembnejša uporaba mehčalcev lepilnih formulacij. Nekateri dolgi verižni estri se uporabljajo za mehčanje plastike, kot je PVC.
- Uporablja se kot aktivator gumijaste polimerizacije. Poleg tega je posrednik pri proizvodnji alkidičnih smol in aditivov za uporabo pri obnovi surove nafte.
- Poleg tega se uporablja pri izdelavi smol, barvil, vlaken, pesticidov in kot spreminjajoče se sredstva poliamidne smole za proizvodnjo poliestra. Uporablja se za vzdrževanje tobačne arome.
Vam lahko služi: binarne soli- Je predhodnik Benzoil -ovega klorida, ki je izhodiščni material za sintezo spojin, kot je benzil benzoat, ki se uporablja pri izdelavi umetnih okusov in žuželk žuželk.
Zdravilno
- Je sestavni del mazila Whitfield. Ta mazilo je sestavljeno iz 6% benzojske kisline in 3% salicilne kisline.
- Je sestavina benzoinske tinkture, ki se uporablja kot vdihavanje topičnega in dekongestičnega antiseptika. Do začetka 20. stoletja so ga uporabljali kot izkašljevanje, analgetično in antiseptik.
- Benzojska kislina se uporablja pri eksperimentalni terapiji bolnikov z preostalimi boleznimi akumulacije dušika.
Ohranjanje hrane
- Benzojska kislina in njegove soli se uporabljajo pri ohranjanju hrane. Spojina je sposobna zavirati rast plesni, kvasovk in bakterij s pomočjo pH -odvisnega mehanizma.
Neprijetno
Lahko reagira z askorbinsko kislino (vitamin C), ki je prisotna v nekaterih pijačah, pri čemer proizvaja benzen, rakotvorsko spojino. Zaradi tega iščejo druge spojine z zmožnostjo ohranjanja hrane, ki ne predstavlja težav benzojske kisline.
Drugi
- Uporablja se v aktivni embalaži, ki je prisotna v ionomerih. Iz njih se sprošča benzojska kislina, ki lahko zavira rast vrst rodov Penicillium in Aspergillus V mikrobnih medijih.
- Uporablja se kot konzervaktivno sredstvo arome sadja in parfumov.
- Benzojska kislina se uporablja kot selektivni herbicid za nadzor plevela s širokimi in travami v sojinih zrnih, kumari, melonah, arašidih in gozdnih okrasnih rastlinah.
Strupenost
- V stiku s kožo in očmi lahko ustvari rdečico. Z vdihavanjem lahko povzroči draženje dihanja in kašlja. Vnos velikih količin benzojske kisline lahko povzroči motnje v prebavilih, pri čemer lahko pride do poškodb jeter in ledvic.
- Benzojska kislina in benzoati lahko sprostijo histamin, ki lahko povzroči alergijske reakcije in draženje oči, kože in sluznice.
- Primanjkuje mu kumulativnega, mutagenega ali rakotvornega učinka, saj se v črevesju hitro absorbira, kar se izloči v urinu, ne da bi se kopičil v telesu.
- Največji dovoljeni odmerek glede na WHO je 5 mg/kg telesne teže/dan, približno 300 mg/dan. Odmerek akutne toksičnosti pri ljudeh: 500 mg/kg.
Reference
- Benzojska kislina. Okreval iz kemijske knjige.com
- Benzojska kislina. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Benzojska kislina. Pridobljeno iz.Wikipedija.org

