Cikloheksenska struktura, lastnosti, sinteza in uporabe

- 3192
- 976
- Ms. Pablo Lebsack
On Cikloheksen Je alken ali ciklični olefin, katerega molekularna formula je c6H10. Sestavljen je iz brezbarvne tekočine, netopna v vodi in mešljiva z mnogimi organskimi topili. Zanj je značilno, da je vnetljiv, v naravi pa ga običajno najdemo v Hulla Tar.
Cikloheksen se sintetizira z delno hidrogenacijo benzena in dehidracijo cikloheksanolnega alkohola; to je bolj oksidiran način. Tako kot drugi cikloalkeni doživlja elektrofilne dodajanje in proste radikale; Na primer reakcija halogenacije.
 Molekula cikloheksena. Vir: Neurotoger.
Molekula cikloheksena. Vir: Neurotoger. Ta ciklična (zgornja slika) tvori aceotropne mešanice (ni ločljivo z destilacijo), z nižjimi alkoholi in ocetno kislino. V dolgotrajnem skladišču ni zelo stabilen, saj se razpade pod delovanjem sončne svetlobe in ultravijoličnega sevanja.
CycloHexen se uporablja kot topilo, zato ima številne aplikacije, kot so: stabilizator bencina z visokim oktanom in ekstrakcija olja.
Najpomembneje pa je, da cikloHexen služi kot posrednik in surovina za pridobivanje številnih spojin velikih uporabnosti, vključno s: cikloheksanonom, adipinsko kislino, maleinsko kislino, cikloheksanom, butinom, cikloheksarboksiličnim kislino itd.
[TOC]
Struktura cikloheksena
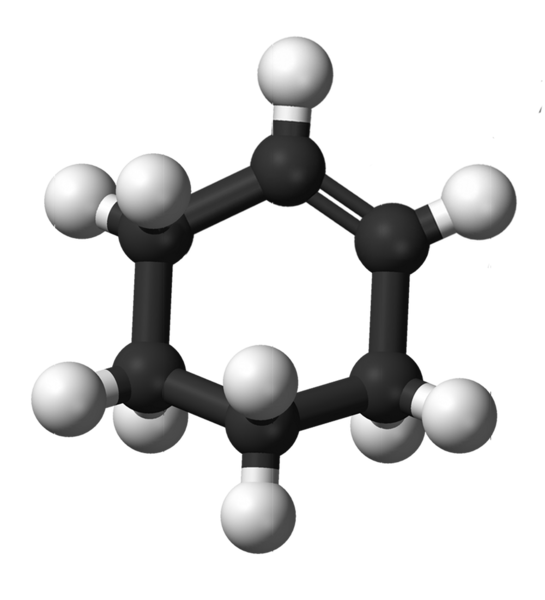 Struktura cikloheksena. Vir: Kemikungen [javna domena]
Struktura cikloheksena. Vir: Kemikungen [javna domena] Zgornja slika prikazuje strukturo cikloheksena z modelom kroglic in palic. Lahko opazite šest -ogljikov obroč in dvojno vez, oba nenasičenost spojine. S tega vidika se zdi, da je prstan raven; Vendar sploh ni.
Za začetek imajo ogljikovi z dvojnim vezanjem hibridizacijo SP2, kar jim daje ravno trigonalno geometrijo. Zato sta ta dva ogljika in tisti, ki so sosednji na njih, najdena v isti ravnini; Medtem ko sta dva ogljika na nasprotnem koncu (do dvojne vezi) zgoraj in pod omenjenim letalom.
Vam lahko služi: specifična gravitacijaSpodnja slika odlično ponazarja na novo razloženo.
 Pogled spredaj na strukturo cikloHeksena. Vir: Ben Mills.
Pogled spredaj na strukturo cikloHeksena. Vir: Ben Mills. Upoštevajte, da je črni trak sestavljen iz štirih ogljikov: dva dvojna vez, drugi. Izpostavljena perspektiva je tista, ki bi jo dobili, če bi gledalca postavil oko tik pred dvojno povezavo. Nato je razvidno, da je ogljik gor in pod to ravnino.
Ker molekula cikloheksena ni statična, se bosta oba ogljika zamenjala: eden se bo spustil, drugi pa se bo dvignil nad letalo. Zato bi bilo pričakovati, da se bo obnašal to molekulo.
Medmolekularne interakcije
CycloHexen je ogljikovodik, zato njene medmolekularne interakcije temeljijo na londonskih disperzijskih silah.
To je zato, ker je molekula apolarna, brez trajnega dipola, njegova molekulska teža.
Prav tako dvojna vez povečuje stopnjo interakcije, saj se ne more premakniti z enako prožnostjo kot pri drugih ogljikih, kar daje prednost interakciji med sosednjimi molekuli. Zaradi tega ima cikloHexen nekoliko večjo vrelišče (83 ° C) kot pri cikloheksanu (81 ° C).
Lastnosti
Kemična imena
Cyclohexen, tetrahidribenzen.
Molekularna teža
82,146 g/mol.
Fizični videz
Brezbarvna tekočina.
Vonj
Sladek vonj.
Vrelišče
83 ° C do 760 mmHg.
Tališče
-103,5 ° C.
točka vžiga
-7 ° C (zaprta skodelica).
Topnost vode
Praktično netopno (213 mg/l).
Topnost v organskih topilih
Mešljiv z etanolom, benzenom, ogljikovim tetrakloridom, oljnim etrom in acetonom. Pričakuje se, da bo lahko raztopil apolarne spojine, na primer nekaj alotropov premoga.
Lahko vam služi: Torio: struktura, lastnosti, pridobivanje, uporabeGostota
0,810 g/cm3 pri 20 ° C.
Gostota pare
2,8 (z zračnim razmerjem, ki je enak 1).
Parni tlak
89 mmHg pri 25 ° C.
Samo-usmeritev
244 ° C.
Razgradnja
Razpade v prisotnosti uranovih soli, pod delovanjem sončne svetlobe in ultravijoličnega sevanja.
Goo
0,625 mpascal pri 25 ° C.
Toplota zgorevanja
3.751,7 kJ/mol pri 25 ° C.
Toplota za uparjanje
30,46 kJ/mol pri 25 ° C.
Površinska napetost
26,26 mn/m.
Polimerizacija
Se lahko polimerizira pod določenimi pogoji.
Prag vonja
0,6 mg/m3.
Lomni količnik
1.4465 do 20 ° C.
ph
7-8 do 20 ° C.
Stabilnost
CycloHexen med dolgotrajnim skladiščenjem ni zelo stabilen. Izpostavljenost svetlobi in zraku lahko povzroči proizvodnjo peroksidov. Je tudi nezdružljiv z močnimi oksidacijskimi sredstvi.
Reakcije
-Cycloalques doživljajo predvsem dodajanje reakcij, tako elektrofilnih kot prostih radikalov.
-Reagira z bromom, da tvori 1,2-dibromocikloheksan.
-Hitro oksidira v prisotnosti kalijevega permanganata (kmno4).
-Sposoben je proizvajati epoksid (cikloheksov oksid) v prisotnosti peroksibenzojske kisline.
Sinteza
CikloHeksen nastaja s kislinskim cikloheksanolnim katalizo:
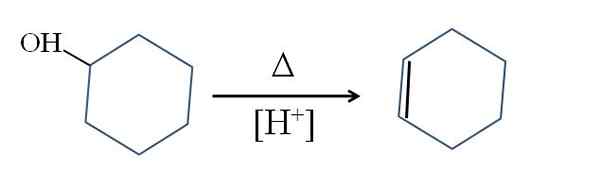 Dehidracija cikloheksanola. Vir: Gabriel Bolívar.
Dehidracija cikloheksanola. Vir: Gabriel Bolívar. Simbol Δ predstavlja toploto, potrebno za spodbujanje izhoda skupine OH kot molekule vode v kislem mediju (-OH2+).
Cyclohexen se pojavlja tudi z delno hidrogenacijo benzena; To pomeni, da dve njegovi dvojni vezi dodata molekulo vodika:
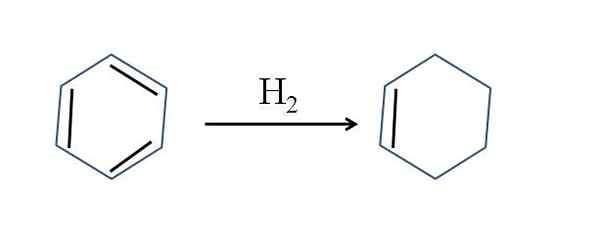 Delno hidrogenacijo benzena. Vir: Gabriel Bolívar.
Delno hidrogenacijo benzena. Vir: Gabriel Bolívar. Čeprav se reakcija zdi preprosta, zahteva odličen h2 in katalizatorji.
Prijave
-Ima uporabnost kot organsko topilo. Poleg tega je surovina za proizvodnjo adipične kisline, adipičnega aldehida, maleinske kisline, cikloheksana in cikloheksilkarboksilne kisline.
Vam lahko služi: radioaktivnost-Uporablja se pri proizvodnji cikloheksanskega klorida, spojine, ki se uporablja kot posrednik priprave farmacevtskih izdelkov in drgnjenja aditiva.
-CycloHexen se uporablja tudi pri sintezi cikloheksanona, surovine za proizvodnjo zdravil, pesticidov, parfumov in barvil.
-CycloHexen posega v sintezo aminocikloheksanola, spojine, ki se uporablja kot površinsko aktivno sredstvo in emulgator.
-Poleg tega lahko CycloHexen uporabimo za pripravo v laboratoriju Butadieno. Ta zadnja spojina se uporablja pri proizvodnji sintetične gume, pri izdelavi avtomobilskih pnevmatik, uporablja pa se tudi pri izdelavi akrilne plastike.
-CycloHexen je surovina za sintezo lizina, fenol, policiloolefin smolo in gumijaste dodatke.
-Uporablja se kot stabilizator bencinov z visokim oktanom.
-Posega v sintezo vodoodpornih premazov, filmov, odporni na razpoke in vezavne mape za prevleke.
Tveganja
CycloHexen ni zelo strupena spojina, vendar lahko povzroči stik z rdečico kože in oči. Njeno vdihavanje lahko povzroči kašelj in zaspanost. Poleg tega lahko njegovo zaužitje povzroči zaspanost, težave z dihanjem in slabostjo.
CycloHexen se v prebavilih malo absorbira, zato resnih sistemskih učinkov zaradi zaužitja ni pričakovati. Največji zaplet je njegova težnja za dihalni sistem, ki lahko proizvede kemično pljučnico.
Reference
- Joseph f. Chiang in Simon Harvey Bauer. (1968). Molekularna struktura cikloheksena. J. A.M. Kem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Ciklohekseen: nevarnosti, sinteza in struktura. Študij. Okrevano od: študij.com
- Morrison, r. T. In Boyd, r. N. (1987). Organska kemija. (5ta Izdaja.). Uredništvo Addison-Wesley Iberoamericana.
- Pubchem. (2019). Ciklohekseen. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Kemijska knjiga. (2019). Ciklohekseen. Obnovi se od: Kemicalbook.com
- Toksikološko podatkovno omrežje. (2017). Ciklohekseen. Toxnet. Okrevano od: Toxnet.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Kemoksi. (s.F.). Strukturna formula za cikloheksen je. Okrevano od: kemoksi.com

