Kolesarjenje
- 2817
- 342
- Stuart Armstrong
 Cucloalquinos
Cucloalquinos Kaj so cikloalkinos?
The Kolesarjenje So organske spojine, ki imajo eno ali več trojnih povezav in ciklično enoto. Njegove kondenzirane molekularne formule Obojujejo formulo cnH2N-4. Če je torej n enak 3, bo formula omenjenega cikloalkvino c3H2.
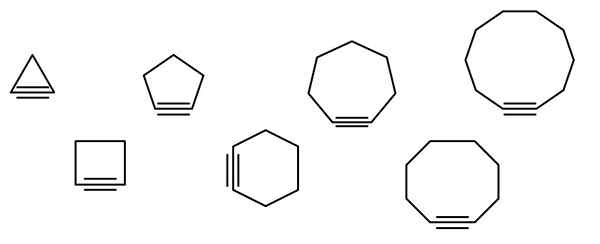
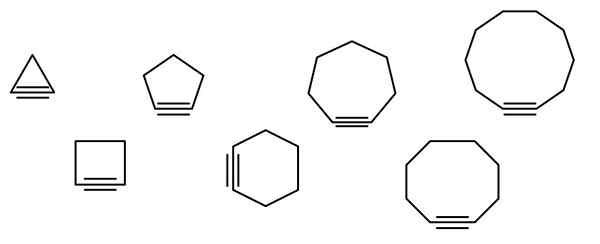
Na vrhunski sliki je prikazana vrsta geometrijskih figur, vendar v resnici sestavljajo primeri cikloalkinov. Vsakega od njih lahko štejemo za bolj oksidirano različico ustreznih cikloalkanov (brez dvojnih ali trojnih povezav). Ko jim primanjkuje heteroátomo (o, n, s, f itd.), so le "preprosti" ogljikovodiki.
Kemija okoli cikloalkinos je zelo zapletena in za njihovimi reakcijami je še več mehanizmov. Predstavljajo izhodišče za sintezo številnih organskih spojin, ki so posledica možnih aplikacij.
Na splošno so zelo reaktivni, razen če so "izkrivljeni" ali tvorijo zapletene s prehodnimi kovinami. Tudi njihove trojne vezi lahko kombiniramo z dvojnimi vezmi, kar ustvarja ciklične enote znotraj molekul.
Če niso tako, lahko v svojih najpreprostejših strukturah dodajo majhne molekule v svoje trojne vezi.
Značilnosti cikloalkinov
Apolarnost in trojna povezava
Za ciktike so značilne, da so apolarne molekule in zato hidrofobne. To se lahko spremeni, če imajo v svojih strukturah katero koli heteroátomo ali funkcionalno skupino, ki daje velik dipolski trenutek; kot v heterocikli s trojnimi povezavami.
Toda kaj je trojna povezava? To ni nič drugega kot tri hkratne interakcije med dvema ogljikovih atomih s hibridizacijo SP. Povezava je preprosta (σ), druga dva pa π, pravokotna drug na drugega. Oba ogljikova atoma imata prosti SP orbital za povezovanje drugih atomov (R-C≡C-R).
Lahko vam služi: radikal za najem: kako se oblikujejo, nomenklatura, primeriTe hibridne orbitale imajo 50% S in 50% znakov P. Ker je orbitala bolj prodorna kot P, to dejstvo naredi dva ogljika trojne vezi več kislin (sprejemnika elektronov) kot ogljikovi alkani ali alkeni.
Zaradi tega trojna vez (≡) predstavlja določeno točko, da se ji dodajo vrste darovalcev elektronov, ki tvorijo preproste povezave.
To ima za posledico rupturo ene od π povezav, ki postane dvojna povezava (c = c). Dodatek se nadaljuje do r4C-Cr4, to je popolnoma nasičena ogljika.
Na zgoraj navedeno je mogoče razložiti tudi na ta način: trojna povezava je dvojna nenasičena.
Medmolekularne sile
Molekule cikloalcina medsebojno delujejo prek disperzijskih sil ali sil Londona in po interakcijah tipa π-x. Te interakcije so šibke, a ker se velikost ciklov povečuje (kot zadnji trije na desni strani slike), jim uspe oblikovati trdne snovi pri temperaturi in zunanjem tlaku.
Kotna napetost
Povezave s trojnimi povezavami so nameščene na isti ravnini in liniji. Zato ima -C≡C- linearno geometrijo z orbitali približno 180 °.
To resno vplete v stereokemično stabilnost cikloalkinov. Veliko energije je potrebno za "zloženje" orbital SP, saj niso prilagodljive.
Manjši kot je cikloalkino, bolj je treba zložiti orbitalne SP, da se omogoči fizični obstoj istega. Analiza slike je mogoče opaziti, od leve proti desni, da je v trikotniku kot povezav na stranice trojne povezave zelo izrazit; Medtem ko so v Decagonu manj nenadni.
Vam lahko služi: metilen modra: značilnosti, priprava, uporabeKer je cikloalkvino večji, je kot vezi orbitalnega SP do idealov 180 ° bližje. Nasprotno se zgodi, ko so manjši, prisilijo jih, da se upognejo in ustvarijo kotna napetost V njih namestitev cikloalkvino.
Tako imajo največji cikloalkini nižjo kotno napetost, kar omogoča njihovo sintezo in shranjevanje. S tem je trikotnik najbolj nestabilen cikel, Decagon pa najbolj stabilen od vseh.
Pravzaprav je ciklooktin (Octagon) tisti z najmanjšim znanim bolj stabilnim; drugi obstajajo le kot trenutni posredniki v kemičnih reakcijah.
Kolesarska nomenklatura
Imenovanje ciklov. Edina razlika je v priponi -ico na koncu imena organske spojine.
Glavna veriga je tista, ki ima trojno povezavo in začne biti našteti od najbližjega konca tega. Če imate na primer ciklopropan. Če je metilna skupina povezana na zgornji točki, potem bo: 2-metilciklopropino.
Ogljiki R-C≡C-R že imajo svoje štiri vezi, tako da nimajo vodikov (kot pri vseh cikloalkini slike). To se ne zgodi le, če je trojna povezava v končnem položaju, torej na koncu verige (R-C≡C-H).
Uporaba cikloalkina
Cycloalcans niso zelo pogoste spojine, zato tudi njihove aplikacije niso. Lahko služijo kot vezive (skupine, ki se usklajujejo) na prehodne kovine in tako ustvarijo neskončnost organometalnih spojin, ki jih je mogoče nameniti zelo strogim in specifičnim namenom.
Vam lahko služi: natrijev bisulfit (nahso3): struktura, lastnosti, uporabe, pridobivanjeObičajno so topila v svojih najbolj nasičenih in stabilnih oblikah. Kadar so sestavljeni iz heterociklov, poleg cikličnih enot C≡C-C = C-C≡C se jim zdijo zanimive in obetavne uporabe, kot so zdravila proti raku; Takšen je primer dimimine do. Druge spojine s strukturnimi analogiji so iz nje sintetizirale.
Primeri ciklokinov
Slika prikazuje sedem preprostih cikloalkinov, v katerih skoraj ni nobene trojne povezave. Od leve proti desni, s svojimi imeni imajo: ciklopropino, trikotnik; Ciclobutino, kvadrat; Cikopentin, pentagon; Cyclohexino, šesterokotnik; Cikloheptino, heptagon; Cyclooctino, Octagon; in ciklodecino, dekagon.
Na podlagi teh struktur in nadomeščanja vodikovih atomov nasičenih ogljikov lahko dobimo druge spojine, ki izhajajo iz njih. Prav tako lahko podvržejo oksidativni pogoji za ustvarjanje dvojnih povezav na drugih straneh ciklov.
Te geometrijske enote so lahko del večje strukture, kar povečuje možnosti za funkcionalizacijo celotnega niza. Ni veliko razpoložljivih primerov cikloalcinov, vsaj ne da bi poglobili dežele organske sinteze in farmakologije.
Reference
- Frančišek a. Želva. Organska kemija. (Šesta izdaja., Stran 372, 375). MC Graw Hill.
- Wikipedija. (2018). Cikloalkyne. Vzeto od: v.Wikipedija.org
- William Reusch. (05. maj 2013). Poimenovanje organskih spojin. Vzeto iz: 2.Kemija.MSU.Edu
- Anorganska kemija. Kolesarjenje. Vzet od: fullquimica.com
- Patrizia Diana in Girolamo Cirrincione. (2015). Biosinteza heterociklov od izolacije do genske grozda. Wiley, stran 181.
- Zanimiva organska kemija in naravni proizvodi. (17. april 2015). Cikloalkynes. Vzeto od: Quintus.Mickel.pogl

