Funkcije in značilnosti centriolosa
- 3773
- 201
- Lee Farrell

The Centriolos So valjaste celične strukture, sestavljene iz skupin mikrotubul. Nastajajo jih tubulinski protein, ki ga najdemo v večini evkariontskih celic.
Povezani par centrilov, obkrožen z množičnim poročilom o gostem materialu, imenovanem pericentriolarni material (PCM), sestavlja strukturo, imenovano Center.
Funkcija centriolov je usmerjanje sestavljanja mikrotubul, ki sodeluje v celični organizaciji (položaj jedra in prostorsko razporeditev celice), tvorba in delovanje flagela in cilije (cilogeneza) ter delitev celic (mitoza in mejoza).
Centriolos najdemo v celičnih strukturah, znanih kot živalske celice in so v rastlinskih celicah odsotne.
Napake v strukturi ali številu centriolov v vsaki celici imajo lahko velike posledice za fiziologijo organizma, kar povzroči spremembe v odzivu na stres med vnetjem, moško neplodnostjo, nevrodegenerativne bolezni in tvorbo tumorjev,, med drugim.
Centriola je cilindrična struktura. Par povezanih centriolov, obkroženih z množičnim poročilom o gostem materialu (imenovane "pericentriolarni material" ali PCM), tvori sestavljeno strukturo, imenovano "centri".
Pred nekaj leti so se smatrali za nepomembne, ko so bile zaključene glavne organele pri izvajanju celične delitve in podvajanja (mitoza) v evkariontskih celicah (predvsem pri ljudeh in drugih živalih).
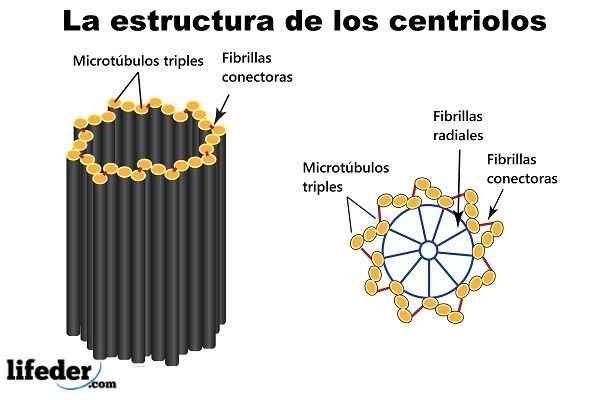
Centriol
Devet mikrotubul trojčkov, razporejenih okoli oboda (ki tvori kratko votlo valj), je "gradbeni bloki" in glavna struktura centriole.
Dolga leta je bila struktura in delovanje centriolov prezrta, čeprav je bila v 1880 -ih centri vizualizirana z optično mikroskopijo.
Theodor Boveri je leta 1888 objavil seminarsko delo, v katerem je opisal izvor centrov iz sperme po oploditvi. V kratkem sporočilu leta 1887 je Boveri napisal to:
„Središče predstavlja dinamično središče celice; Njegova delitev ustvarja oblikovane središča hčerinskih celic, okoli katerih so vse druge celične komponente organizirane simetrično ... centri so pravi delitveni organ celice, na polovici jedrske in celične delitve “(Scheer, 2014: 1). [Avtor prevod].
Kmalu po sredini dvajsetega stoletja je z razvojem elektronske mikroskopije vedenje centriolov preučil in razložil Paul Schafer.
Na žalost je bilo to delo v veliki meri ignorirano zaradi dejstva, da se je zanimanje raziskovalcev začelo osredotočati na ugotovitve Watsona in Kricka na DNK.
Središče

Par centriolov, ki se nahajajo v bližini jedra, in pravokotno drug na drugega, je "centriranje". Eden od centriolov je znan kot "oče" (ali mati). Drugi je znan kot "sin" (ali hči; je nekoliko krajša in ima svojo bazo pritrjeno na materino bazo).
Proksimalni konci (v povezavi obeh centriolov) so potopljeni v "oblak" beljakovin (morda do 300 ali več), znanega kot organizacijski center za mikrotubule (MTOC), saj zagotavlja potreben protein za gradnjo gradnje mikrotubule.
Vam lahko služi: sposobnost preživetja raziskavMTOC je znan tudi kot "pericentriolarni material" in ima negativno obremenitev. Obratno, distalni konci (stran od povezave obeh centriolov) so pozitivno naloženi.
Par centriolov, skupaj z okoliškim MTOC, sta znana kot "središče".
Podvajanje centrov
Ko se centrioli začnejo podvajati, se oče in sin rahlo ločita in nato vsaka centriola začne oblikovati nov centriolo v njegovi bazi: oče z novim sinom in sin z novim sinom ("vnuk" ).
Medtem ko se podvajanje centriole pojavlja, se tudi jedrna DNK podvaja in ločuje. Sedanje raziskave kažejo, da sta podvajanje centriole in ločitev DNK nekako povezana.
Delitev podvajanja in celic (mitoza)

Mitotski proces je pogosto opisan v smislu pobudne faze, znane kot "vmesnik", ki mu sledijo štiri faze razvoja.
Med vmesnikom se centrioli podvojijo in se ločijo na dva para (eden od teh vrstnikov se začne premikati proti nasprotni strani jedra) in DNK je razdeljen.
Po podvajanju centriolov se mikrotubule centriolov razprostirajo in poravnajo vzdolž glavne osi jedra, ki tvorijo "mitotično vreteno".
V prvi od štirih faz razvoja (faza I ali "Profas") se kromosomi kondenzirajo in pristopijo, jedrska membrana. Hkrati se mitotsko vreteno nastaja s centriolskimi pari, ki se nahajajo na koncih vretena.
V drugi fazi (faza II ali "metafaza") so verige kromosomov poravnane z osjo mitotskega vretena.
V tretji fazi (faza III ali "anafaza") se kromosomske verige razdelijo in se premaknejo proti nasprotnim koncem mitotskega vretena, zdaj podolgovate.
Nazadnje v četrti fazi (faza IV ali "telofaza") nastanejo nove jedrske membrane okoli ločenih kromosomov, mitotsko vreteno se razveljavi in ločitev celic se začne dokončati s polovico citoplazme, ki gre z vsakim novim jedrom.
Na vsakem koncu mitotskega vretena imajo centriolni pari pomemben vpliv (očitno povezane s silami, ki jih izvajajo elektromagnetna polja, ki jih ustvarjajo negativne in pozitivne obremenitve njihovih proksimalnih in distalnih koncev) v celotni celici celične delitve.
Centri in imunski odziv
Izpostavljenost stresu vpliva na funkcijo, kakovost in trajanje življenja organizma. Usmerjeni stres, na primer z okužbo, lahko privede do vnetja okuženih tkiv, ki aktivira imunski odziv v telesu. Ta odziv ščiti prizadeto telo in odpravlja patogen.
Številni vidiki funkcionalnosti imunskega sistema so dobro znani. Vendar so molekularni, strukturni in fiziološki dogodki, v katerih so vpleteni centri, še vedno enigma.
Vam lahko služi: Poročilo o eksperimentuNedavne študije so odkrile nepričakovane dinamične spremembe v strukturi, lokaciji in funkciji centrov v različnih pogojih, povezanih s stresom. Na primer, po imitaciji pogojev okužbe je bilo ugotovljeno povečanje proizvodnje PCM in mikrotubul v vmesniških celicah.
Centri v imunskih sinapsah
Centri imajo zelo pomembno vlogo pri strukturi in delovanju imunskih sinaps (SI). To strukturo tvori specializirane interakcije med T celico in antigenom, ki predstavlja celico (CPA). Ta interakcija celičnih celic se začne selitev centriranja proti SI in njeno nadaljnjo povezavo do plazemske membrane.
Sredinska sklopka v SI je podobna tisti, ki so ga opazili med cilogenezo. Vendar v tem primeru ne začne sestavljanja cilije, ampak sodeluje v organizaciji SI in izločanju citotoksičnih veziklov, da lisar ciljne celice postane ključni organ pri aktivaciji T celic.
Sredinski in vročinski stres
Centri so tarča "molekularne molekularne Chaperonas" (nabor beljakovin, katerega funkcija je pomagati zložiti montažo in celični transport drugih beljakovin), ki zagotavljajo zaščito pred izpostavljenostjo termičnemu šoku in stresu.
Med dejavniki stresa, ki vplivajo na sredine, je vključena poškodba DNK in toplote (kot je bila ta, ki jo utrpijo vročinske bolniške celice). Poškodba DNK se začne poti popravljanja DNK, kar lahko vpliva na delovanje središč in sestave beljakovin.
Stres, ki nastane s toploto, povzroči spremembo strukture centriole, motnje središč in popolno inaktivacijo njegove sposobnosti tvorjenja mikrotubul, spreminjanje tvorbe mitotičnega vretena in preprečevanje miitoze.
Prekinitev funkcije centrov med vročino bi lahko bila prilagodljiva reakcija na inaktiviranje vretenskih drogov in preprečevanje nenormalne delitve DNK med mitozo, zlasti glede na potencialno disfunkcijo multipskih beljakovin po denaturaciji, ki jo povzroča toploto.
Prav tako bi lahko zagotovila celico, da obnovi svoj funkcionalni beljakovinski bazen, preden ponovno zažene delitev celic.
Druga posledica inaktivacije centriranja med vročino je njegova nezmožnost, da se premakne na to, da ga organizira in sodeluje pri izločanju citotoksičnih veziklov.
Nenormalni razvoj centriolov
Razvoj centriolo je proces precej zapleten, in čeprav v njem sodeluje vrsta regulativnih beljakovin, se lahko pojavijo različne vrste napak.
If there is an imbalance in the proportion of proteins, the centriolo child can be defective, its geometry can be distorted, the axes of a pair can deviate from perpendicularity, multiple children can develop, the centriole son can reach the full length before time, ali pari ločitve lahko zamujajo.
Lahko vam služi: naravno in socialno okolje v zadovoljevanju človeških potrebKadar je napačno ali napačno podvajanje centriolov (z geometrijskimi napakami in / ali večkratno podvajanje), je razmnoževanje DNK spremenjeno, je predstavljena kromosomska nestabilnost (CIN).
Prav tako centri centrov (na primer povečano ali razširjeno centriranje) vodijo v CIN in spodbujajo razvoj več centriolov otrok.
Te razvojne napake povzročajo škodo na celicah, ki lahko celo privedejo do malignih.
Nenormalne centriole in maligne celice
Zahvaljujoč intervenciji regulativnih beljakovin, ko se pri razvoju centriolov in/ali centriranja odkrijejo nepravilnosti, lahko celice izvedejo samoporedovanje anomalij.
Če pa lahko dosežemo samo korekcijo anomalije, nenormalnih centriolov ali z več otroki ("nadštevilčne centriole".
Superumerarni centrioli se ponavadi zberejo, kar vodi do združevanja centrov ("ojačanja centrov", značilno za rakave celice), spreminjanje celične polarnosti in normalnega razvoja mitoze, kar ima za posledico pojav tumorjev.
Za celice z nadštevilčnimi centriolami je značilno, da predstavljajo presežek pericentriolarni material, prekinitev valjaste strukture ali prekomerne dolžine neependikularnih ali slabo postavljenih centriolov in centriolov.
Domneva se, da bi grozdi centriolov ali središč v rakavih celicah lahko služili kot "biomarker" pri uporabi terapevtskih in Imaginoloških sredstev, kot so superparamagnetni nanodelci.
Reference
- Borisy, g., Heald, r., Howard, J., Janke, c., Musacchio, a., & Nogales in. (2016). Mikrotubule: 50 let od odkritja tubulina. Nature pregleduje molekulsko celično biologijo, 17 (5), 322-328.
- Buchwalter, r. Do., Chen, j. V., Zheng in., & Megraw, t. L. Centri v delitvi celic, razvoju in bolezni. Els.
- Gambarotto, d., & Basto, r. (2016). Zaposlej pomanjkljivosti numeričnih središč v razvoju in bolezni. V cistoskeletu mikrotubula (pp. 117-149). Springer Dunaj.
- Huston, r. L. (2016). Pregled centriolne aktivnosti in napačne aktivnosti med delitvijo celic. Napredek v bioznanosti in biotehnologiji, 7 (03), 169.
- Inaba, k., & Mizuno, k. (2016). Disfunkcija sperme in ciliopatija. Reproduktivna medicina in biologija, 15 (2), 77–94.
- Keeling, j., Tsiokas, l., & Maskey, D. (2016). Celični mehanizmi za nadzor ciliarne dolžine. Celice, 5 (1), 6.
- Lodish, h., Berk, a., Kaiser, c. Do., Krieger, m., Bretscher, a., Ploegh, h., Amon, a., Martin, k. C. (2016). Biologija molekulskih celic. New York: W. H. Freeman in družba.
- Matamoros, a. J., & Baas, str. W. (2016). Mikrotubule v zdravju in degenerativne bolezni živčnega sistema. Bilten za raziskave možganov, 126, 217-225.
- Pellegrini, l., Wetzel, a., Grannó, s., Heaton, g., & Harvey, k. (2016). Nazaj na tubulo: Dinamika mikrotubul pri Parkinsonovi bolezni. Celične in molekularne znanosti o življenju, 1-26.
- Scheer, u. (2014). Zgodovinske korenine raziskav centrov: odkritje Boverijevih mikroskopskih diapozitivov v Würzburgu. Phil. Trans. R. Soc. B, 369 (1650), 20130469.

